Adsorption
Ang sikat na "H5N1" ay nangangahulugang "hemagglutinin type five, neuraminidase type one" - ang dalawang protina na ito ay lumalabas sa ibabaw ng influenza virus (sa Fig. 1, ang hemagglutinin ay berde at ang neuraminidase ay kulay abo).
Sa tulong ng hemagglutinin, ang influenza virus ay nakakabit sa mga receptor sa ibabaw ng mga selula. Ang unang target ng virus ay ang mga selula ng ciliated epithelium ng respiratory tract, ngunit hindi ito ang dahilan kung bakit mahal natin ito: ang hemagglutinin ay maaaring ilakip sa mga receptor ng maraming iba pang mga selula, kabilang ang mga pulang selula ng dugo. Kung ang isang virus ay nakakabit sa dalawang (katabing) pulang selula ng dugo nang sabay, ang mga pulang selula ng dugo ay magkakadikit! Samakatuwid ang pangalan ng protina - "dugo-gluing".
kanin. 1
Pagpapatupad
Ang tangang cell ay sumisipsip ng virus na nakakabit dito sa pamamagitan ng phagocytosis - tulad ng, kinakain ito. Bakit, bakit ang mga bata ay laging naglalagay ng lahat ng uri ng masasamang bagay sa kanilang mga bibig?! Gayunpaman, ang virus ay nasa loob pa rin ng cell bilang pagkain, sa loob ng isang phagocytotic vesicle (sa Fig. 2 - "endosome"). Ang endosome ay sumasama sa lysosome, nabuo ang isang digestive vacuole, ang mga proton ay pumped dito mula sa cytoplasm upang lumikha ng isang acidic na kapaligiran (ang prosesong ito ay ipinapakita sa Fig. 2) - kaunti pa, at kami ay digest ang virus (na may mga salitang "pagkain ng protina, ano ang pagkakaiba").

kanin. 2
Maghubad
Ngunit handa na ang virus para sa mga pangyayaring ito:
 kanin. 3 |
- Ang Hemagglutinin ay binago sa ilalim ng impluwensya ng isang acidic na kapaligiran - ang ibabaw nito ay nagiging hydrophilic, at ito (dating naka-attach sa receptor sa panloob na ibabaw ng endosome membrane, ngayon) ay naka-embed sa loob ng lamad na ito.
- Ang mga proton na nabomba sa endosome ay dumadaan sa mga espesyal na protina ng channel (mga protina ng M2, na ipinahiwatig sa Fig. 1 at Fig. 3) sa pamamagitan ng lipid shell ng virus at maabot ang protina na shell ng virus (sa Fig. 1 - isang bilog ng mga puting bola - M1 protina). Dahil dito, ang shell ng protina ay nawasak (sa Fig. 3, ang mga protina ng M1 ng nawasak na shell ng protina ay ipinahiwatig bilang mga pulang bituin).
- Ang lipid envelope ng virus (dahil sa tumatagos na pagkilos ng hemagglutinin) ay sumasama sa (lipid) lamad ng phagosome; Ang RNA ng virus ay napupunta sa cytoplasm ng cell.
Pagtitiklop ng virus
Ang virus na RNA na inilabas sa cytoplasm ay ganap na ligtas.
- Ang mga protina ay hindi maaaring gawin dito, dahil ito ay minus RNA (ang mga protina ay hindi naka-encode nito, ngunit sa pamamagitan ng komplementaryong plus strand nito, na hindi pa umiiral).
- Imposible ring gumawa ng RNA dito - ang ating mga cell sa pangkalahatan ay walang enzyme na may kakayahang magdoble ng RNA.
"Oh-ho-ho, wala kang kahit ano," bulong ng virus ng trangkaso, nanginginig ang kanyang bigote na ulo, "pero okay lang, dinala ko lahat." Dinala ng virus ang mga protina na PB1, PB2 at PA, na magkakasamang bumubuo sa viral RNA-dependent na RNA polymerase - maaari itong duplicate ang RNA. Pero malas! Ang anumang polymerase ay nangangailangan ng isang panimulang aklat upang magsimulang magtrabaho, ngunit ang nakakalimot na trangkaso ay hindi kinuha ito! Tapos na ba?!
Huminahon ka, huwag mag-panic! - Sa mga salitang ito, ang buong kumpanya (8 viral RNA at 3 viral enzymes) ay ipinadala sa cell nucleus. Doon ang trangkaso ay makakakuha ng buong serbisyo:
- Ang mga panimulang aklat para sa pagtitiklop ng viral RNA (upang makakuha ng plus RNA) ay mga seksyong na-cleaved mula sa cellular RNA;
- pagproseso: mga lugar na nagsilbing primer para sa synthesis ng RNA - ito ay mga takip, kaya ang pagbabago ng 5" na dulo ay isinasagawa sa pinakadulo simula; sa pagtatapos ng synthesis, ang polyadelation ng 3" na dulo ay nangyayari;
- splicing: ilang viral RNA na naglalaman ng impormasyon para sa dalawang protina ay pinuputol sa dalawang bahagi.
Sa ganitong paraan, ang mga plus RNA ay na-synthesize, na maaaring magsilbi bilang mga template para sa synthesis ng mga viral protein at viral minus RNAs.
Kung gayon ang lahat ay simple: ang hangal na selula, gamit ang sarili nitong mga ribosom mula sa sarili nitong mga amino acid, ay synthesize ang mga protina ng virus, kabilang ang RNA-dependent RNA polymerase. Ang influenza minus RNA ay masigla ring ginawa sa loob ng nucleus. Ang pagpupulong ng mga particle ng viral ay nangyayari sa cytoplasm, sa panloob na ibabaw ng lamad ng cell. Ang natapos na virus ay umalis sa cell sa pamamagitan ng exocytosis (budding), ang neuraminidase ay kumagat sa huling thread na nag-uugnay sa cell at bagong panganak na virus... Isang bagong (masamang) maliit na buhay ang lumabas sa mundo!

kanin. 4
SA FLU IRISES: MGA PANGYAYARI AT PAGTATAYA
D.K. Lvov, A.D. Zaberezhny, T.I. Aliper
Dmitry Konstantinovich Lvov, akademiko ng Russian Academy of Medical Sciences, direktor ng Research Institute of Virology na pinangalanan. DI. Ivanovsky RAMS, Pinuno ng Kagawaran ng Virology, Moscow Medical Academy na pinangalanan. SILA. Sechenov. Project Manager 05-04-52136, 06-04-48822.
Alexey Dmitrievich Zaberezhny, Doctor of Biological Sciences, pinuno ng laboratoryo ng molecular diagnostics ng parehong instituto, pinuno ng departamento ng molecular biology ng NPO Narvak.
Taras Ivanovich Aliper, Doctor of Biological Sciences, pinuno ng laboratoryo ng mga paraan ng tiyak na pag-iwas sa mga sakit na viral ng parehong instituto, direktor ng NPO Narvak.
Para sa unang publikasyon ng artikulo, tingnan ang: Kalikasan. 2006. Blg. 6. pp. 3–13.
Ang mga epidemya ng trangkaso ay nangyayari bawat taon at hindi itinuturing na isang bagay na hindi pangkaraniwang. Dahil ang sakit ay sanhi ng mga virus na pamilyar na sa immune system, ito
Bilang isang patakaran, nakayanan niya ang mga ito. Ang pandemya ay isa pang usapin: sa kasong ito, ang causative agent ng trangkaso ay isang virus na may mga bagong antigenic at biological na katangian, mabilis na kumakalat sa buong mundo, na nakakaapekto sa hanggang isang-kapat ng populasyon ng planeta at kumikitil ng sampu-sampung milyong buhay. Ito ang nagpatanyag sa mga pandemya noong nakaraang siglo. Imposibleng mahulaan ang mga ito, tulad ng imposibleng pangalanan ang eksaktong oras ng pagsisimula ng bago.
Gayunpaman, ngayon, salamat sa patuloy na pagsubaybay sa mga virus na nagpapalipat-lipat sa mga tao, domestic at ligaw na hayop, pati na rin ang kaalaman na nakuha gamit ang mga molecular genetic na pamamaraan, posible nang mahulaan ang paglitaw ng mga bagong variant ng virus na may mga tendensya sa pandemya. Sa mga nagdaang taon, natukoy ang isang kandidato para sa tungkuling ito: ang una na hindi pathogen avian virus na H5N1 sa pagtatapos ng 2003 ay nagdulot ng epizootic ng trangkaso sa mga manok, na naging panzootic ngayong taon. Ang virus na ito ay nagsimulang makahawa sa iba pang mga hayop, kabilang ang mga tao, ngunit hindi pa maipapasa mula sa tao patungo sa tao. Upang makuha nito ang kakayahang ito, sapat na upang palitan lamang ang isang amino acid sa isa sa mga viral protein.
Mga istruktura ng Virion
Ang istraktura ng influenza virus ay medyo simple: ito ay isang spherical particle (virion) na may diameter na humigit-kumulang 0.13 microns, sa core, na naglalaman ng nucleocapsid (isang RNA molecule na nakabalot sa isang shell ng M1 protein), na napapalibutan ng isang lipid lamad (Larawan 1). Tatlong protina ang nahuhulog sa lamad na ito - hemagglutinin, neuraminidase at isang ion channel (M2 protein), na may malaking papel sa nakakahawang proseso.
Ang Hemagglutinin ang unang nakipag-ugnayan sa mga host cell receptor. Sa ibabaw ng viral envelope ito ay ipinakita sa anyo ng mga napaka-kumplikadong trimer. Ang bawat isa sa kanilang mga monomer ay matatag na naka-angkla sa lamad at naglalaman ng dalawang subunits - ang isa sa mga ito ay nagsisiguro ng pangunahing pakikipag-ugnay sa target na cell, ang isa ay responsable para sa pagsasanib ng mga viral at cellular membrane. Sa tuktok ng protina mayroong mga rehiyon na nagbubuklod sa sialic acid, na bahagi ng host cell receptor.
Tinatanggal ng enzyme neuraminidase ang mga terminal sialic acid na grupo ng mga cellular receptor, bilang isang resulta kung saan ang cell ay nawalan ng kakayahang makilala ang antigen at ang virus ay tumagos.

B OLOGY AT MEDICAL SCIENCE | Mga virus ng trangkaso: mga kaganapan at hula |
pumapasok ito sa pamamagitan ng endocytosis, isang karaniwang paraan ng paghahatid ng mga sangkap sa cell. Ang acidic na kapaligiran ng endosome budding mula sa cell membrane ay nagpapagana sa M2 ion channel, na nagpapababa ng pH sa loob ng viral particle, na humahantong sa pagkasira ng M1 protein shell. Kasabay nito, ang hemagglutinin ay isinaaktibo. Ito ay na-synthesize sa anyo ng isang precursor, na sa isang acidic na kapaligiran ay pumasa sa isang mature na estado - ito ay na-cleaved ng proteolytic enzymes sa dalawang subunits, habang ang fusion peptide na nakatago sa loob ng trimer ay nagbabago ng conformation, ay inilabas, gumagalaw sa itaas na dulo. ng molekula at ipinapasok sa lamad. Ang viral envelope ay sumasama sa endosomal, isang fusion pore ay nabuo, kung saan ang isang landas ay bubukas sa cytoplasm para sa dayuhang genetic na materyal. Ang viral RNA pagkatapos ay pumapasok sa cell nucleus. Bilang resulta, ang mga mahahalagang proseso ng cell ay nagambala, at ang cell mismo, gamit ang sarili nitong mga mapagkukunan, ay nagsisimulang gumawa ng mga viral protein. Kaagad, nangyayari ang pagtitiklop ng viral RNA at ang mga bagong partikulo ng viral ay natipon, na, sa tulong ng neuraminidase, ay inilabas mula sa mga nasirang selula (ang kanilang mga produkto ng pagkasira ay nagdudulot ng pagkalasing ng katawan at isang febrile state) at kumalat sa buong katawan sa pamamagitan ng daluyan ng dugo.
Fig. 1. Diagram ng virion ng influenza virus. Ang lipoprotein shell nito ay natatakpan ng mga spine ng dalawang glycoproteins - hemagglutinin at neuraminidase. Sa loob ay mayroong isang nucleocapsid - isang molekula ng RNA na nakabalot sa isang shell ng M1 na protina. Ang genome ay binubuo ng walong mga fragment, kung saan ang unang anim ay nag-encode ng isang protina bawat isa (hemagglutinin - HA, neuraminidase - NA, RNA polymerase subunits - PB1, PB2, PA, nucleoprotein
NP), at ang huling dalawang gene - dalawang protina bawat isa ay may natatanging mga pagkakasunud-sunod ng amino
noacids (matrix proteins - M1, M2 at non-structural proteins - HS1, HS2).
Pinipigilan ng multiplied na virus ang hematopoietic at immune system, sinisira ang endothelium ng mga capillary, na humahantong sa pagtaas ng vascular permeability at hemorrhages, kabilang ang cerebral edema na may nakamamatay na kinalabasan. Ngunit ito ay medyo bihirang mangyari, kadalasan ang immune system ay lumiliko - una, ang mga kadahilanan ng likas (hindi tiyak) na kaligtasan sa sakit ay kasangkot, at pagkaraan ng ilang sandali ay nagsisimulang gumawa ng mga tiyak na antibodies, na naglalabas sa kanila at, sa muling impeksyon, protektahan ang katawan mula sa virus.
Ang isang natatanging tampok ng mga virus ng trangkaso ay ang mataas na pagkakaiba-iba ng mga katangian ng antigenic. Ang mga panloob na protina ay pare-pareho sa kanilang istraktura at tinutukoy ang uri ng virus (A, B at C). Ang mga antigen sa ibabaw, sa kabaligtaran, ay magkakaiba at nagbabago, at higit pa

B OLOGY AT MEDICAL SCIENCE | Mga virus ng trangkaso: mga kaganapan at hula |
Nalalapat din ito sa hemagglutinin (H), na, kasama ng neuraminidase (N), ay tumutukoy sa subtype ng virus (H1N1, H2N2, H3N2, atbp.). Ang antigenic variability ng surface proteins ay sanhi ng dalawang genetic na proseso - drift at shift na mga pagbabago sa viral genome.
Ang mga pagbabago sa drift ay sanhi ng mga mutasyon ng punto sa mga gene na naka-encode ng hemagglutinin at neuraminidase at humahantong sa mga maliliit na pagbabago sa istruktura ng mga protina na ito. Karaniwan, ang mga naturang pagbabago ay nangyayari sa pagitan ng mga pandemya para sa lahat ng uri ng mga virus (A, B at C). Bilang resulta, ang mga epidemya sa halip na mga pandemya ay nangyayari bawat taon, dahil nananatili ang proteksyon mula sa mga nakaraang kontak sa virus, bagaman ito ay hindi sapat.
Nagaganap ang mga pagbabago sa shift pagkatapos ng kumpletong pagpapalit ng gene. Posible ito dahil naka-segment ang genome ng influenza virus - binubuo ito ng walong fragment ng single-stranded linear RNA, encoding, bilang karagdagan sa hemagglutinin at neuraminidase, isang virus-specific enzyme (RNA polymerase, o transcriptase, na binubuo ng tatlong subunits. - protina PB1, PB2, PA), pati na rin ang isang nucleoprotein (NP ), matrix (M1 at M2) at nonstructural (NS1 at NS2) na mga protina. Kapag ang isang cell ay sabay na nahawahan ng dalawang magkaibang strain, ang mga segment ng kanilang mga replicating genome ay pinaghalo sa anumang kumbinasyon, kaya ang mga bagong virion ay naglalaman ng iba't ibang hanay ng mga gene na hiniram mula sa bawat isa sa mga orihinal na virus. Ang kumbinasyong ito ng mga segment ng viral RNA ay tinatawag na genetic shuffling, o reassortment, upang hindi malito sa umiiral nang termino - recombination, kung saan ang genetic na materyal ay muling inayos alinman sa pamamagitan ng crossing-over na mekanismo o bilang resulta ng pagbabago sa ang template. Ang mga pagbabago sa shift, bilang panuntunan, ay nakakaapekto sa antigenic na istraktura ng hemagglutinin, mas madalas - neuraminidase. Kaya, sa hindi regular na pagitan (10-40 taon), lumilitaw ang mga virus na may mga bagong antigenic at biological na katangian, kabilang ang mga bagong variant ng pandemya.
Harang ng species
Kabilang sa mga virus na maaaring maging sanhi ng mga emerhensiyang sitwasyon ng epidemya, ang paglaban sa kung saan sa yugto ng kanilang paglitaw ay mahirap o kahit na imposible, ang mga virus ng trangkaso A ay partikular na mapanganib nomenclature, sa pamamagitan ng 16 na subtype ng hemagglutinin (H1-16) at 9 neuraminidase (N1-9). Ang mga virus na ito ay laganap sa kalikasan at maaaring makahawa sa lahat ng mga species ng mga ibon at ilang mga species ng mammals (mga tao, kabayo, baboy, balyena, seal, atbp.). Ang impeksyon ng mga mammal ay nangyayari pangunahin sa pamamagitan ng respiratory tract, at sa mga ibon - sa pamamagitan ng mga bituka. Ang kanilang impeksyon ay karaniwang walang sintomas o sa anyo ng enteritis, na nagpapahiwatig ng mataas na antas ng pagbagay sa isa't isa ng mga virus ng trangkaso at mga ligaw na ibon, na maaaring ituring na kanilang mga likas na host. Ang virus ay nananatili sa tubig, sa +22°C - hanggang isang buwan, sa +4°C at mas mababa - sa mas mahabang panahon (6-8 na buwan), samakatuwid ang water-fecal route ng impeksyon ay ang pangunahing mekanismo para sa pagpapanatili patuloy na sirkulasyon ng influenza virus sa kalikasan.
Sa kabila ng antigenic heterogeneity, ang mga virus na may lahat ng kilalang kumbinasyon ng mga protina sa ibabaw ay nahiwalay lamang sa mga ligaw na ibon ng aquatic at semi-aquatic complex - mga duck, gull, atbp. (Larawan 2).
Tanging ang mga virus na may ilang partikular na hanay ng mga protina sa ibabaw ang umiikot sa iba pang mga hayop: halimbawa, hanggang kamakailan lamang, ang mga virus ng tatlong hemagglutinin subtypes lamang (H1-H3) at dalawang neuraminidase subtypes (N1-N2) ay nakahiwalay sa mga tao. Lahat ng apat na pandemya ng ikadalawampu siglo. ay sanhi ng mga bagong shift variant ng mga subtype na ito: ang "Spanish flu" noong 1918 ay sanhi ng influenza A virus ng H1N1 subtype, ang "Asian flu" noong 1957 - H2N2, ang "Hong Kong flu" noong 1968 - H3N2 at ang "Russian flu" noong 1977 - H1N1. Ang lahat ng mga ito ay mga reassortant ng avian at human influenza virus.

B OLOGY AT MEDICAL SCIENCE | Mga virus ng trangkaso: mga kaganapan at hula |
Hanggang kamakailan, pinaniniwalaan na ang mga virus ng avian influenza ay hindi pathogenic para sa mga tao at, kung nahawahan, maaari lamang magdulot ng conjunctivitis at banayad na malaise, at sa mga bihirang kaso, isang mild respiratory syndrome. Gayunpaman, noong 1997, ang mga virus ng H5N1 ay nagdulot ng napakalubhang uri ng sakit sa mga tao sa Hong Kong - sa 18 katao na nagkasakit, anim ang namatay, lahat sila ay nakuha mula sa mga manok. Ang pangalawang katulad na episode ay naganap noong Pebrero 2003, gayundin sa Hong Kong - sa limang nahawaang tao, dalawa ang namatay. Ang mga virus ng H5N1 ay pana-panahong nahiwalay sa mga manok at iba pang uri ng ibon (kabilang ang mga ligaw) sa mga lokal na populasyon.
Fig.2. Scheme ng sirkulasyon ng mga kilalang subtype ng mga virus ng influenza A.
Ang H9N2 serotype virus, na laganap sa mga manok sa Tsina at iba pang mga bansa sa Asya, ay nakita sa limang Tsino noong Agosto 1998, at makalipas ang isang taon sa Hong Kong sa dalawang batang babae na may klinikal na larawan ng karamdamang tulad ng trangkaso. Kapansin-pansin na ang lahat ng mga kaso ng sakit ay nangyari nang nakapag-iisa sa isa't isa, at walang paghahatid ng mga virus mula sa tao patungo sa tao. Noong 1996, ang H7N7 avian influenza virus ay nahiwalay sa isang babaeng nagdurusa sa conjunctivitis. Isang kaso sa Netherlands ang nagresulta sa kamatayan. Ang mga ito ay mga kaso lamang na opisyal na naitala; sa katotohanan, ang mga virus ng avian influenza ay nagtagumpay sa hadlang ng mga species, tila mas madalas, at nagsisimulang makahawa hindi lamang sa mga tao, kundi pati na rin sa iba pang mga hayop (baboy, kabayo, balyena, minks, atbp.) . May mga kilalang kaso ng impeksyon ng mga manok (manok, pabo) na may mga virus ng trangkaso na katangian ng mga ligaw na ibon, lalo na ang mga waterfowl.
Mahirap pa ring kumpiyansa na hatulan ang lahat ng mga salik na naglilimita sa hanay ng host ng virus at ang mga mekanismong nakakaimpluwensya sa pagbabago ng host. Ang paghahanap na ito ay isinasagawa sa loob ng mahabang panahon, sa iba't ibang grupo ng pananaliksik, kabilang ang sa aming institute.
Ang Hemagglutinin ang unang hinala, dahil ang glycoprotein na ito ang may pananagutan sa pagkilala sa mga host cell receptor at kasangkot sa pagsasanib ng viral envelope sa endosomal envelope (esensyal, bahagi ng cytoplasmic envelope ng host cell). Ang istraktura ng mga receptor na ito ay nag-iiba depende sa species at tissue na pinagmulan ng mga cell. Ang mga pagkakaibang ito ay mahalaga para sa paglilimita sa paglipat ng mga virus sa pagitan ng mga species at partikular na pinag-aralan kaugnay ng paglitaw ng mga bagong pandemya na virus ng tao.
Ito ay itinatag na ang mga receptor ng epithelial cells ng respiratory tract ng tao, bilang karagdagan sa protina, ay naglalaman ng carbohydrates - sialo-oligosaccharides, kung saan ang terminal sialic acid (N-acetylneuraminic acid) ay konektado sa galactose sa pamamagitan ng isang 2′-6 ' bond, at ang mga cell receptor

B OLOGY AT MEDICAL SCIENCE | Mga virus ng trangkaso: mga kaganapan at hula |
avian intestinal epithelium - 2′-3′. Ang mga virus ng avian influenza ay hindi maganda ang pag-reproduce sa katawan ng tao dahil hindi sila makakaugnayan sa mga receptor ng tao. Kasabay nito, ang mga mucins (sa likas na katangian ng parehong kumplikadong glycoproteins na may sialic acid sa dulo), na obligadong protektahan ang mga baga ng tao mula sa mga microorganism, ay naglalaman ng mga receptor na may 2′-3′ galactose bond. Kaya, ang isang avian influenza virus na hindi sinasadyang pumasok sa katawan ng tao ay hindi maaaring tumagos sa mga cell, dahil walang mga tiyak na receptor sa kanilang ibabaw, at ang aktibidad ng pagkilala ng mga virion receptor ay hinarangan ng mucin, kaya ang isang tao sa kasong ito ay nakaharap lamang sa isang bahagyang runny nose. .
Ngunit sa kasong ito, paano natin maipapaliwanag ang paglitaw ng mga variant ng pandemic shift ng virus? Ang sitwasyon ay naging mas malinaw nang malaman na ang mga selula ng respiratory tract ng baboy ay nagdadala ng parehong uri ng mga receptor at, nang naaayon, ay maaaring mahawaan ng mga virus ng trangkaso ng parehong mga tao at mga ibon. Nangangahulugan ito na ang mga baboy ay maaaring magsilbi bilang isang intermediate host para sa iba't ibang mga virus at isang perpektong arena para sa kanilang reassortment sa panahon ng magkahalong impeksyon.
Tulad ng para sa hemagglutinin, ang kakayahang makilala ang mga host cellular receptor ay lilitaw na pangunahing nauugnay sa istraktura ng receptor binding site (RBS). Kaya, sa mga virus ng trangkaso ng tao, ang PCC ay naglalaman ng mga amino acid na leucine at serine sa mga posisyon 226 at 228, ayon sa pagkakabanggit, at sa mga avian virus, ang glutamine at glycine ay matatagpuan sa mga posisyon na ito. Ang iba pang mga pagpapalit ng amino acid ay natagpuan sa PCC sa iba't ibang mga hayop, ibig sabihin, kahit na ang PCC ay natipid at evolutionarily stable, mayroon pa rin itong mga variable na rehiyon na nakakaapekto sa receptor binding (affinity) at specificity.
Ang PCC ay maaaring magbago pagkatapos na malampasan ng virus ang interspecies na hadlang, halimbawa, ay maaaring makakuha ng kakayahang makilala ang mga cell receptor ng tao. Ang patunay na malalampasan ang bird-human species barrier ay ang 1997 human influenza outbreak sa Hong Kong na dulot ng avian H5N1 virus.
Ipinapalagay na ang "attachment" ng virus sa host ay tinutukoy hindi lamang ng mga katangian ng hemagglutinin, kundi pati na rin ng isa pang protina sa ibabaw - neuraminidase. Bilang karagdagan, may dahilan upang maniwala na ang mga gene ng panloob at hindi istruktura na mga protina ng mga virus ng influenza A ay kasangkot sa paglilimita sa hanay ng mga host Gayunpaman, masyadong maaga upang pag-usapan ito, dahil kailangan pa ring pag-aralan ang kontribusyon ng bawat gene at ang mga function ng kanilang mga produkto. Gayunpaman, mahalagang maunawaan na kahit na ang kaunting mga pagbabago sa istraktura ng mga viral protein, lalo na ang hemagglutinin, ay maaaring humantong sa mga makabuluhang pagbabago hindi lamang sa hanay ng host ng virus, kundi pati na rin sa antas ng pathogenicity nito (virulence).
Virulence
Alalahanin natin na para sa pagpaparami ng virus sa katawan ng host, ang pag-activate ng precursor ng molekula ng hemagglutinin ay kinakailangan, at ito ay nahati ng host protease sa dalawang subunits. Ang proteolysis ng hemagglutinin ng mga low-pathogenic na avian virus ay nangyayari sa isang limitadong bilang ng mga uri ng cell, kaya ang virus ay naisalokal lamang sa respiratory o intestinal tracts. Nangyayari ito sa mga asymptomatic o katamtamang impeksyon. Ang mga hemagglutinin ng mga highly pathogenic avian virus ay pinapasama sa iba't ibang mga cell at samakatuwid ay may kakayahang magdulot ng nakamamatay na mga systemic na impeksyon, lalo na sa mga manok.
Ang iba't ibang mga laboratoryo sa buong mundo ay nagsimulang pag-aralan ang genome ng highly pathogenic influenza virus strains para sa mga tao (H5N1 at H7N7, isolated noong 1997-2004). Ito ay lumabas na ang mga virus na ito ay naglalaman ng ilang mga pangunahing amino acid sa cleavage site ng hemagglutinin molecule, na nagbibigay sa kanila ng mataas na nakakahawang aktibidad at pathogenicity. Hindi tulad ng mga non-pathogenic o mahinang pathogenic na mga virus, na walang ganitong amino acid sequence, ang hemagglutinin ng mga highly pathogenic virus ay madaling masira hindi lamang ng mga tulad-trypsin na protease na nasa mga selula ng respiratory tract ng tao at ng bituka ng mga ibon, ngunit din sa pamamagitan ng furin-like protease. Kumilos sila sa kumbinasyon

B OLOGY AT MEDICAL SCIENCE | Mga virus ng trangkaso: mga kaganapan at hula |
na may ubiquitin, na idinisenyo upang markahan ang mga protina na kailangang sirain para sa mga protease. Ang mga protease na tulad ng furin ay na-synthesize sa iba't ibang mga tisyu, na nagbibigay sa mga pathogenic na virus ng kakayahang makahawa sa iba't ibang mga sistema at organo. Upang baguhin ang isang low-pathogenic na virus sa isang highly pathogenic, ang pagpasok ng kahit isang pangunahing amino acid sa proteolytic cleavage site ng hemagglutinin ay sapat na.
Ito ay kasunod na nakumpirma sa mga eksperimento sa mga daga na nahawaan ng iba't ibang mga variant (nakahiwalay sa iba't ibang taon) ng H5N1 virus. Ang ilan sa mga ito ay nagsimulang magtiklop sa utak, atay, pali, at mga selula ng dugo, na nagdulot ng 100% na pagkamatay ng mga daga sa ikapito hanggang ikawalong araw pagkatapos ng impeksyon, habang ang ibang mga virus ay naging hindi pathogen para sa mga daga at dumami lamang sa mga daga. baga. Ito ay ipinaliwanag sa lalong madaling panahon - sa mga H5N1 na virus na nakahiwalay noong 2004, kung ihahambing sa mga virus na nakuha noong 1997-2003, ang mga karagdagang mutasyon sa hemagglutinin gene ay nakilala, na nakakaapekto sa pagbabago sa kanilang mga antigenic na katangian.
Ang pathogenicity ng virus ay maaaring maapektuhan ng mga pagbabago sa istraktura ng hindi lamang ibabaw kundi pati na rin ang mga panloob na protina. Kaya, natuklasan ang isang mutation sa posisyon 627 sa protina ng PB2 sa H5N1 influenza virus strain, na lubhang pathogenic para sa mga daga. Ang mutation na ito ang nakaimpluwensya sa pagkakaiba sa mga katangian ng dalawang H5N1 virus na nakahiwalay sa Hong Kong, at bilang resulta, ang resulta ng nakakahawang proseso. Bilang karagdagan, ang virulence ng mga virus ng trangkaso na ito ay nauugnay sa mga tampok na istruktura ng non-structural protein NS, lalo na, sa pagkakaroon ng glutamic acid sa molekula nito sa posisyon 92, na ginagawang lumalaban ang mga virus sa antiviral na pagkilos ng mga interferon. .
Siyempre, ang paggamit ng mga modernong molecular genetic na pamamaraan sa pag-aaral ng mga virus ng trangkaso ay unti-unting nililinaw ang kanilang mga biological na katangian, ngunit ang mga tradisyonal na pamamaraan na sumusubaybay sa sirkulasyon ng mga virus ng trangkaso sa mga tao, domestic at ligaw na hayop ay hindi gaanong mahalaga. Ang paghula sa paglitaw ng mga reassortant na may mga tendensiyang pandemya at pagbuo ng mga epektibong hakbang para sa pag-iwas at pagkontrol sa trangkaso ay maaari lamang mabuo batay sa pag-aaral ng ekolohiya at ebolusyon ng mga pathogen nitong mahirap hulaan at mahirap kontrolin ang nakakahawang sakit. Nagsimula ang naturang pananaliksik mahigit 35 taon na ang nakararaan ni G. Laver sa Australia, R. Webster sa USA, D.K. Lvov sa ating bansa, at nagpapatuloy sila hanggang ngayon sa buong mundo.
Mga kaganapan at hula
Isang komprehensibong pag-aaral ng mga virus ng trangkaso A ang pinasimulan ng World Health Organization (WHO) pagkatapos ng pandemya noong 1968 na dulot ng H3N2 virus. Itinatag ng aming instituto na ang ninuno ng H3N2 ay isang strain na katulad ng H3N8 virus na nakahiwalay sa Ukraine noong 1963 mula sa mga ligaw na duck. Ang mga ito at ang iba pang data ay nagsilbing batayan para sa pagbuo ng isang siyentipikong direksyon - ang ekolohiya at ebolusyon ng mga virus ng influenza A ay nilikha na may isang network ng mga base ng suporta, kung saan nakuha ang mga bagong data na. kinumpirma ang kawalan ng mga pangunahing pagkakaiba sa pagitan ng mga virus ng trangkaso A ng mga tao at hayop, ibig sabihin, .e. ang pagkakaroon ng isang solong protektadong gene pool. Ayon sa mga datos na ito, noong 1980 isang klasipikasyon ng mga virus ng trangkaso ay nilikha anuman ang kanilang pinagmulan. Simula noon, ang bawat nakahiwalay na virus ay bibigyan ng isang pangalan, na sumasalamin sa uri ng virus, pinagmulan ng paghihiwalay, lugar at taon ng paghihiwalay, pati na rin ang isang subtype - halimbawa, A/duck/Ukraine/63(H3N8).
Ang pangunahing layunin ng aming pananaliksik sa Russia ay pag-aralan ang ebolusyon ng mga virus ng trangkaso A sa proseso ng pakikipag-ugnayan ng mga populasyon ng viral sa mga populasyon ng mga ligaw na ibon at alagang hayop at ang pagbuo ng mga strain na may potensyal na epidemya. Para sa layuning ito, ang pagsubaybay ay isinasagawa sa mga pangunahing punto sa Northern Eurasia; 14 sa 16 na kilalang mga virus ay nakahiwalay
Sa pagtatapos ng 2003, i.e. tatlong buwan bago ang pagsiklab ng epidemya na dulot ng H5N1 avian influenza virus sa mga bansa sa Southeast Asia, isa sa mga may-akda ng artikulong ito (D.K. Lvov) ay nagsalita sa internasyonal na kongreso ng trangkaso sa Japan, na nag-uulat ng paghihiwalay ng mga virus na ito.

B OLOGY AT MEDICAL SCIENCE | Mga virus ng trangkaso: mga kaganapan at hula |
mula sa mga ligaw na ibon sa Russia - sa Altai at sa timog ng Primorye. Ayon sa molecular genetic data, ang mga strain na ito ay inuri bilang mababang pathogenic. Pagkatapos, sa pamamagitan ng pagkakatulad sa mga naunang obserbasyon, ang unang hula ay ginawa tungkol sa posibilidad ng kanilang pagpapakilala sa mga migratory bird sa mga poultry farm sa Timog-silangang Asya, kung saan pagkaraan ng ilang panahon maaari silang maging lubhang pathogenic na may potensyal na panzootic at pandemya. Tila ito ang nangyari. Ang pagsiklab ng epizootic ay kumalat sa 10 bansa sa maikling panahon. Sa nakalipas na panahon, mahigit 150 milyong manok at itik ang namatay at napatay. Ayon sa WHO, sa pagtatapos ng Marso 2006, 185 katao na ang nahawahan, 104 sa kanila ang namatay. Ang epidemya ay nagpapatuloy, at ang mga virus ay tumagos din sa mga populasyon ng baboy, na partikular na nakababahala. Ang mundo ay maaaring nasa bingit ng isang epidemiological na sakuna: ang mga reassortant ay maaaring mabuo anumang oras kapag ang mga baboy ay sabay-sabay na nahawahan ng H5 avian virus at ang H1 o H3 human influenza virus na kumakalat sa buong mundo.
Ang pangalawang hula ay ginawa din: kung ang mga ligaw na ibon ay nahawaan ng mataas na pathogenic strains sa mga lugar ng taglamig, ang panganib ng kanilang pagpapakilala sa Russia ay tumataas, lalo na sa Siberia at sa Malayong Silangan, sa panahon ng paglipat ng tagsibol. At saka nangyari ang dapat mangyari. Noong kalagitnaan ng Hulyo 2005, sa mga populated na lugar ng rehiyon ng Novosibirsk, na matatagpuan sa loob ng lacustrine hilagang kagubatan-steppe ng Baraba Lowland, ang isang epizootic sa mga manok ay nakita na may rate ng namamatay na higit sa 90% at mabilis na pagkalat.
Ang mga materyales ay nakolekta mula sa mga domestic at ligaw na ibon na nakatira sa malapit na lugar ng epizootic site. Gamit ang mga linya ng cell ng SPEV at MDCK (kasalukuyang patent ang hindi kinaugalian na pamamaraang ito), naghiwalay kami ng anim na strain ng H5N1 mula sa manok at mahusay na grebe (Podiceps cris tatus), na may napakataas na konsentrasyon ng tissue ng virus. Sa priority na may petsang Agosto 8, 2005, ang mga strain na ito ay idineposito sa State Collection of Viruses, at ang sequencing data ng kanilang full-length genome ay idineposito sa GenBank na may priority na may petsang Setyembre 5, 2005. Ang site ng proteolytic cutting ng hemagglutinin ng lahat ng nakuhang strain ay naglalaman ng pagkakasunud-sunod ng amino acid na PQGERRRKKRGLF, katangian ng mga highly pathogenic avian influenza virus. Ang mga pagkakasunud-sunod ng nucleotide ng hemagglutinin genes ng lahat ng nasuri na mga virus ng manok ay naging ganap na magkapareho, ngunit naiiba sa strain na nakahiwalay sa isang ligaw na ibon (grebe), bagaman sa pamamagitan lamang ng dalawang pagpapalit ng nucleotide (Larawan 3). Ang pagsusuri ng phylogenetic ay nagsiwalat ng mataas na antas ng homology sa pagitan ng mga hemagglutinin ng mga strain ng West Siberian at mga strain na nakahiwalay sa tagsibol ng parehong taon mula sa bar-headed na goose (Anser indicus) sa Lake. Kukunar sa hilagang-kanlurang lalawigan ng Qinghai (PRC). Ito ay ganap na nakumpirma kapag pinag-aaralan ang natitirang pitong gene.
Ang pagkakakilanlan ng mga genetic na katangian ng mga nakahiwalay na mga strain ay nagpapatunay ng isang direktang koneksyon sa pagitan ng mga virus na nagpapalipat-lipat sa mga populasyon ng mga ligaw at domestic na ibon. Kasabay nito, ang mga strain ng H5N1 influenza virus na natuklasan noong 2005 ay malaki ang pagkakaiba sa mga strain ng virus na ito na nakahiwalay sa mga nakaraang taon, kabilang ang mula sa A/Vietnam/1194/2004(H5N1) strain na nakuha mula sa England, na inaalok sa ating bansa. para sa paggawa ng bakuna. Malinaw na, hindi bababa sa isang bakuna sa beterinaryo, isang strain lamang mula sa State Collection of Viruses na tumutugma sa antigenic properties sa virus na kumakalat sa Russia ang maaaring gamitin.
Ang strain na aming ibinukod, na idineposito sa State Collection of Viruses, ay ginagamit na para sa malakihang produksyon ng bakuna sa Federal State Unitary Enterprise Stavropol Poultry Farm. Ang mga manok ay binabakunahan sa Southern Federal District. Sa pamamagitan ng Hunyo 15, 2006, ito ay binalak na gumawa ng 15 milyong dosis ng bakuna, na may karagdagang pagpapalawak ng produksyon.
Sa pamamagitan ng paraan, sa isang pandemya, kapag kinakailangan upang mabilis na maitaguyod ang paggawa ng isang bakuna, ipinapayong, sa aming opinyon, na gumamit ng mga linya ng cell kung saan ang virus ng trangkaso ay mabilis na naipon sa mataas na konsentrasyon bilang isang substrate. Ang bagong binuo na pamamaraan na ito ay may makabuluhang pakinabang kaysa sa tradisyonal, na gumagamit

B OLOGY AT MEDICAL SCIENCE | Mga virus ng trangkaso: mga kaganapan at hula |
Ang mga embryo ng manok ay nilikha: habang ang lahat ng mga antigenic na domain ng hemagglutinin ay napanatili, ang kulturang bakuna ay nag-aalis ng paglitaw ng mga komplikasyon na nauugnay sa protina ng manok. Ito ay lalong mahalaga kapag gumagawa ng mga bakuna para sa mga tao. Kailangan mo lang malaman kung aling strain ang dapat gamitin para mabakunahan ang mga tao. Magdedepende ito sa antigenic na profile ng umuusbong na variant ng pandemya. Marahil ito ay magiging iba sa kung ano ito ngayon. Sa anumang kaso, ang paggamit ng isang live na bakuna ay ganap na hindi katanggap-tanggap. Ang genetic na pakikipag-ugnayan sa pagitan ng bakuna at mga field na virus ay maaaring humantong sa paglitaw ng mga reassortant na may hindi inaasahang kahihinatnan.
Fig.3. Ang antas ng pagkakaugnay ng mga pagkakasunud-sunod ng nucleotide ng hemagglutinin gene ng influenza A virus subtype H5 variants na nakahiwalay sa mga ligaw at domestic na ibon sa iba't ibang bansa sa nakalipas na 10 taon. Highly pathogenic H5N1 strains ng Qinghai-Novosibirsk group of virus ay naka-highlight sa bold.
Ang pagsusuri ng genome ng mga strain na aming nahiwalay ay nagsiwalat ng isang bilang ng mga tampok na nauugnay sa mga biological na katangian. Bilang karagdagan sa pagkakasunud-sunod ng amino acid ng proteolytic cleavage site ng hemagglutinin, na tumutukoy sa mataas na antas ng pathogenicity ng virus, ang mga pagtanggal ay natagpuan sa mga posisyon 49-68 sa neuraminidase (genotype Z), na nagpapahiwatig ng isang pagtaas ng tropismo ng mga virus na namin. ihiwalay para sa manok at potensyal na pathogenicity para sa mga tao. Tinutukoy ng glutamic acid sa posisyon 92 ng NS1 protein ang resistensya ng virus sa interferon at tumaas na virulence sa mga baboy. Ang lysine sa posisyon 627 ng protina ng PB2 ay nagpapaliwanag ng kakayahan ng mga pinag-aralan na mga strain na magparami sa iba't ibang mga linya ng mammalian cell. Ang mga natukoy na katangian ng virus na pumasok sa Russia ay nagpapahiwatig ng mataas na pathogenicity nito laban sa mga manok at mga tao.
Ang pagkakaroon ng serine, at hindi asparagine, sa ika-31 na posisyon ng M2 ay nagpapahiwatig ng sensitivity ng virus sa rimantadine, na ganap na kasabay ng data mula sa isang direktang pag-aaral ng epekto ng mga antiviral na gamot sa pagpaparami ng virus. Para sa mga layuning ito, gumamit din kami ng mga linya ng cell at nalaman namin na para sa pag-iwas at maagang paggamot ng trangkaso, parehong mamahaling gamot sa ibang bansa - halimbawa, Tamiflu, at medyo murang mga domestic, na magagamit sa mga parmasya - remantadine, ay parehong epektibo at maaari gamitin.

B OLOGY AT MEDICAL SCIENCE | Mga virus ng trangkaso: mga kaganapan at hula |
virazole (para sa intravenous at aerosol na paggamit), arbidol. Sa kasamaang palad, ang produksyon ng mga gamot na ito ay kasalukuyang wala o hindi sapat sa bansa, at ito ay kagyat na lumikha ng kanilang mga strategic reserves.
Paano at kailan pumasok sa Russia ang highly pathogenic H5N1 influenza virus, at paano bubuo ang mga karagdagang kaganapan?
Fig.4. Mga ruta ng pagkalat ng H5N1 influenza virus sa wild at domestic bird populations. Ang mababang pathogenic influenza virus (LPIVs) na nakahiwalay sa mga ligaw at domestic na ibon sa hilagang-silangan na rehiyon ng Altai Territory noong 1991 at sa timog ng Primorsky Territory noong 2001, maliwanag na ang mga pasimula ng pagsiklab ng trangkaso sa Hong Kong noong 1997 at epizootics noong timog-silangang Asya noong 2003-2005, gayundin sa hilagang-kanluran ng China noong 2005. Dahil naging highly pathogenic (HPPV), ang mga virus na ito ay tumagos sa panahon ng paglipat ng mga ligaw na ibon sa tagsibol sa Kanlurang Siberia, kung saan nagdulot sila ng pagsiklab ng trangkaso noong tag-araw ng 2005 sa mga manok. Sa panahon ng paglipat ng mga aquatic at semi-aquatic na ibon, higit na kumalat ang HPAV sa hilaga at kanluran ng Eurasia, at noong taglamig ng 2006 ang mga virus na ito ay natuklasan na sa Africa. Ang mga makapal na arrow ay nagpapahiwatig ng impeksyon ng influenza virus mula sa ligaw
mga ibon sa mga domestic at vice versa.
Una, ang mga low-pathogenic strain na nagpapalipat-lipat sa Siberia at sa Malayong Silangan sa mga ligaw na ibon ay ipinakilala sa panahon ng paglilipat ng taglagas sa mga bansa sa Timog-silangang Asya (Larawan 4). Ang pagkakaroon ng lubhang pathogenic doon, sila, kasama ang mga ligaw na ibon, ay pumasok sa Kanlurang Siberia noong tagsibol ng 2005 at naging mas aktibo sa panahon kung kailan lumitaw ang mga sisiw. Ang mataas na pathogenic strains ay kumalat kasama ng mga ibon sa mga nesting site sa isang lugar na higit sa 10 milyon.
km2. Matapos makapasok ang virus sa populasyon ng manok, isang pagsiklab ng epizootics ang naganap. Seryoso ito at pangmatagalan.
Ang pangatlong hula ay na kapag ang mga ibon ay lumipad pabalik sa kanilang taglamig na lugar sa taglagas sa pamamagitan ng mga lugar na makapal ang populasyon ng Russia at iba pang mga bansa, muli nilang ikakalat ang virus.

B OLOGY AT MEDICAL SCIENCE | Mga virus ng trangkaso: mga kaganapan at hula |
At nangyari nga. Noong taglagas ng 2005, ang virus ay nakarating na sa karamihan ng mga bansa sa Europa, natagpuan din ito sa Turkey, Crimea, Iran, Azerbaijan, Georgia, India, at gayundin sa Africa. At dito nakarating kami sa Tula, Kalmykia at sa Volga delta, kung saan naganap ang pagsiklab ng trangkaso sa populasyon ng mute swan (Cygnusolor) noong Disyembre 2005 pagkatapos ng maikling stopover ng lumilipad na hilagang pato - tufted duck (Aythya fuligula). Ang mga strain na nakahiwalay sa swans, ayon sa kanilang molecular genetic analysis, ay kabilang din sa Qinghai-West Siberian group of virus. Sa loob ng anim na buwang sirkulasyon sa mga ligaw na ibon, napanatili ng mga strain ang kanilang genotype at hindi nawala ang kanilang mataas na pathogenicity.
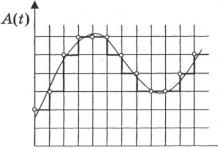
Ang ika-apat na pagtataya ay ang pinaka-nakaaalarma. Nahawahan ng virus ang maraming anyong tubig sa mga nesting area at sa mga ruta ng paglipad, at mananatili ito roon hanggang sa tagsibol. Ang bawat natural na anyong tubig na naglalaman ng mga dumi mula sa mga nahawaang ibon ay nagiging "time bomb." Ito ay maihahambing sa pagkakasangkot ng mga peatlands sa isang taiga fire. Sa tagsibol, ang mga infected at malulusog na ibon ay babalik at lilipad sa mga "minefields" na ito, kaya ang mga kaganapan sa tag-araw ng 2006 ay maaaring mas mapanganib kaysa sa nakaraang season. Kinumpirma ito ng mala-avalanche na paglala ng sitwasyon sa Europe, Asia at Africa noong Marso na. Panzootic na ito. At kapag ang highly pathogenic strains na nagpapalipat-lipat sa mga ligaw na ibon sa tagsibol ay bumalik sa mababang pathogenic, imposibleng mahulaan kung gaano katagal ang proseso ng kanilang reassortment - mga buwan o taon. Malinaw na ito ay isang paksa ng priyoridad na pag-aaral, kung saan nakasalalay ang pag-unlad ng mga kaganapan sa nakikinita na hinaharap.
Tungkol naman sa pandemic virus, maaari rin itong umusbong sa ating bansa matapos mahawaan ng human at avian virus ang mga baboy. Ngunit ito ay malamang na dumating sa amin mula sa China, kung saan ang mga posibilidad para sa pagbabago ng reassortant ay lalong malaki, dahil sa aktibidad ng proseso ng epizootic at ang malaking madaling kapitan ng contingent sa populasyon. Ang isang pandemya na virus ay maaaring lumitaw sa ating bansa anumang oras - para dito, sapat na ang isang amino acid substitution sa PCC ng hemagglutinin, bilang isang resulta ang virus ay magsisimulang makilala ang mga receptor ng mga selula ng tao at, nang naaayon, ay magsisimulang maging ipinadala mula sa tao patungo sa tao.
Ano, mula sa aming pananaw, ang dapat gawin ngayon sa antas ng estado ay nakabalangkas sa talahanayan. Bibigyan natin ng espesyal na pansin ang pag-aaral sa karagdagang ebolusyon ng mga highly pathogenic strains na nakaapekto sa populasyon ng ligaw na ibon. Ang mga ekosistema sa teritoryo ng Russia ay may mahalagang kahalagahan dito. Plano naming ipagpatuloy ang pagsubaybay sa bahagi ng Europa ng bansa, sa Siberia at Malayong Silangan, at gayundin, posibleng, sa ilang kalapit na bansa.
Sa nakalipas na limang taon, ang aming pananaliksik ay isinagawa nang magkasama sa mga game wardens, ornithologist, at mga empleyado ng pederal na phyto-veterinary at sanitary epidemiological na serbisyo ng mga rehiyon ng Novosibirsk, Astrakhan, Irkutsk, Primorsky Territory, Birobidzhan, Republics of Kalmykia at Buryatia. Ang lahat ng ito ay naganap sa loob ng balangkas ng mga programang pederal na "Proteksyon laban sa mga pathogens", "Pagbuo ng mga paraan at pamamaraan para sa pagkontra sa bioterrorism", "Influenza A ng mga baboy at ibon: pakikipag-ugnayan ng mga populasyon".
Ang mga ito ay intracellular obligate na mga parasito, ibig sabihin ay hindi nila maaaring kopyahin o ipasa ang kanilang mga gene nang walang tulong. Ang isang solong viral particle (virion) ay hindi gumagalaw. Kapag nahawahan ng virus ang isang cell, gumagamit ito ng mga enzyme at karamihan sa istruktura ng cell upang magtiklop.
Hindi tulad ng nakikita natin sa mga proseso ng paghahati ng cell tulad ng at, ang pagtitiklop ng virus ay gumagawa ng maraming progeny na sumisira sa host cell at pagkatapos ay nakahahawa sa iba pang mga cell sa katawan.
Viral na genetic na materyal
Ang mga virus ay maaaring maglaman ng single-stranded/double-stranded DNA o RNA. Ang uri ng genetic material na matatagpuan sa isang partikular na virus ay depende sa kalikasan at paggana nito. Ang eksaktong katangian ng kung ano ang mangyayari pagkatapos mahawaan ang isang host ay nag-iiba depende sa likas na katangian ng virus.
Magiiba ang proseso ng pagtitiklop para sa dsDNA, ssDNA, dsRNA, at ssRNA virus. Halimbawa, ang mga double-stranded na DNA virus ay karaniwang dapat pumasok sa mga host cell bago sila maaaring magtiklop. Gayunpaman, ang mga single-stranded na RNA virus ay pangunahing gumagaya sa mga host cell.
Kapag nahawahan ng virus ang isang host, ang mga bahagi ng viral progeny ay ginawa ng cellular machinery, at ang pagpupulong ng viral capsid ay isang non-enzymatic na proseso. Ang mga virus ay kadalasang makakahawa lamang ng limitadong bilang ng mga host. Ang mekanismo ng "lock at key" ay ang pinakakaraniwang paliwanag para sa hindi pangkaraniwang bagay na ito. Ang ilang partikular na protina sa particle ng virus ay dapat tumugma sa ilang mga receptor ng protina sa ibabaw ng cell ng isang partikular na host.
Paano nakakahawa ang mga virus sa mga cell?
Ang pangunahing proseso ng impeksyon at pagtitiklop ng virus ay nangyayari sa 6 na yugto:
- Adsorption - ang virus ay nagbubuklod sa host cell.
- Entry - ipinapasok ng virus ang genome nito sa host cell.
- Viral genome replication - Ang viral genome ay ginagaya gamit ang cellular structure ng host.
- Pagpupulong - nabuo ang mga sangkap at enzyme ng viral at nagsisimulang mag-ipon.
- Maturation - nabuo ang mga virus mula sa mga naka-assemble na bahagi.
- Exit - lumabas ang mga bagong virus sa host cell upang maghanap ng mga bagong biktima na mahawahan.
Ang mga virus ay maaaring makahawa sa anumang uri ng cell, kabilang ang
Kasama sa pamilya ng mga orthomyxovirus (Greek orthos - tama, tukha - mucus) ang mga uri ng influenza virus na A, B, C, na, tulad ng paramyxovirus, ay may kaugnayan sa mucin. Ang mga virus ng Influenza A ay nakahahawa sa mga tao at ilang uri ng hayop (kabayo, baboy, atbp.) at mga ibon. Ang mga virus ng trangkaso na mga uri B at C ay pathogenic lamang para sa mga tao. Ang unang human influenza virus ay nahiwalay sa mga tao noong 1933 nina W. Smith, C. Andrews at P. Ladow (WS strain) sa pamamagitan ng pagkahawa sa mga puting ferrets. Nang maglaon, ang virus na ito ay inuri bilang type A. Noong 1940, natuklasan nina T. Francis at T. Megill ang influenza virus type B, at noong 1949, natuklasan ni R. Taylor ang influenza virus type C. Kapag nag-uuri ng mga virus ng trangkaso, palaging mayroong ilang mga paghihirap na nauugnay sa kanilang antigenic variability. Ang mga virus ng trangkaso ay nahahati sa tatlong uri A, B at C. Kasama sa Uri A ang ilang mga subtype na naiiba sa bawat isa sa kanilang mga antigen - hemagglutinin at neuraminidase. Ayon sa klasipikasyon ng WHO (1980), ang uri A ng virus ng trangkaso ng tao at hayop ay nahahati sa 13 antigenic subtype para sa hemagglutinin (H1-H13) at 10 para sa neuraminidase (N1-N10). Sa mga ito, ang mga virus ng trangkaso ng tao na A ay kinabibilangan ng tatlong hemagglutinin (HI, H2 at H3) at dalawang neuraminidases (N1 at N2) Para sa uri ng virus, ang subtype ng hemagglutinin at neuraminidase ay ipinahiwatig sa mga panaklong. Halimbawa, influenza A virus: Khabarovsk/90/77 (H1N1).