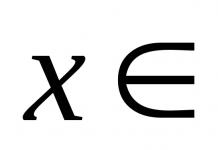Wat geeft het periodenummer aan? Scheikunde en kreeg het beste antwoord
Antwoord van TheLastDreamer[goeroe]
Een periode is een rij van het periodieke systeem van chemische elementen, een reeks atomen in volgorde van toenemende nucleaire lading en het vullen van de buitenste elektronenschil met elektronen.
Het periodiek systeem heeft zeven perioden. De eerste periode, die twee elementen bevat, en de tweede en derde, die elk acht elementen bevatten, worden klein genoemd. De overige perioden met 18 of meer elementen zijn groot. De zevende periode is niet voltooid. Het nummer van de periode waartoe een chemisch element behoort, wordt bepaald door het aantal elektronenschillen (energieniveaus).
Elke periode (behalve de eerste) begint met een typisch metaal (Li, Na, K, Rb, Cs, Fr) en eindigt met een edelgas (He, Ne, Ar, Kr, Xe, Rn), dat wordt voorafgegaan door een typisch niet-metaal.
Het ladingsnummer van de atoomkern (synoniemen: atoomnummer, atoomnummer, rangnummer van een chemisch element) is het aantal protonen in de atoomkern. Het ladingsgetal is gelijk aan de lading van de kern in eenheden van elementaire lading en tegelijkertijd gelijk aan het serienummer van het chemische element dat overeenkomt met de kern in het periodiek systeem.
Een groep van het periodieke systeem van chemische elementen is een reeks atomen in toenemende nucleaire lading die dezelfde elektronische structuur hebben.
Het groepsnummer wordt bepaald door het aantal elektronen in de buitenste schil van het atoom (valentie-elektronen) en komt in de regel overeen met de hoogste valentie van het atoom.
In de kortetermijnversie van het periodieke systeem zijn de groepen verdeeld in subgroepen: hoofd (of subgroepen A), beginnend met elementen van de eerste en tweede periode, en secundaire (subgroepen B), die d-elementen bevatten. Subgroepen worden ook genoemd naar het element met de laagste kernlading (meestal het element van de tweede periode voor de hoofdsubgroepen en het element van de vierde periode voor secundaire subgroepen). Elementen van dezelfde subgroep hebben vergelijkbare chemische eigenschappen.
Met een toename van de nucleaire lading van elementen van dezelfde groep, als gevolg van een toename van het aantal elektronenschillen, nemen de atoomstralen toe, wat resulteert in een afname van de elektronegativiteit, een toename van de metallische eigenschappen en een verzwakking van de niet-metallische eigenschappen van de elementen, een toename van de reductie en verzwakking van de oxidatieve eigenschappen van de stoffen die ze vormen.
De Laatste Dromer
Opperste Intelligentie
(104014)
Lees hierboven.
Antwoord van Yoldar Baizjanov[goeroe]
Het toont het aantal elektronen en protonen.
Antwoord van 2 antwoorden[goeroe]
Hallo! Hier vindt u een selectie van onderwerpen met antwoorden op uw vraag: Wat geeft het periodenummer weer? Scheikunde
De kwestie van het onderwerp scheikunde heeft, zoals elke filosofische vraag, een historisch terugblik.
Pre-alchemistische periode
Als praktijkgebied heeft de chemie wortels in de oudheid. Lang vóór onze jaartelling maakte de mens kennis met de transformaties van verschillende stoffen en leerde hij deze voor zijn behoeften te gebruiken. Tot de oorsprong van de scheikunde behoren de atomistische leer, die destijds alternatief was, en de leer van de elementaire elementen van de oude natuurfilosofie.
Alchemistische periode
In de 3e-4e eeuw na Christus. e. Alchemie ontstond in Alexandrië en erkende de mogelijkheid om onedele metalen om te zetten in edele metalen - goud en zilver - met behulp van de steen der wijzen. Het belangrijkste in de chemische leer van deze periode was de observatie van individuele eigenschappen van stoffen en hun verklaring met behulp van stoffen (principes) die zogenaamd in de samenstelling van deze stoffen waren opgenomen.
Periode van eenwording van de chemie
In de 15e en 16e eeuw begon Europa een periode van snelle groei in handel en materiële productie. Tegen de 16e eeuw had de technologie in Europa een niveau bereikt dat aanzienlijk hoger was dan tijdens de hoogtijdagen van de Oude Wereld. Tegelijkertijd liepen de veranderingen in de technische technieken hun theoretische kennis voor. Verdere verbetering van de technologie berustte op de belangrijkste tegenstrijdigheid van die tijd: de tegenstelling tussen het relatief hoge niveau van technologische kennis dat tegen die tijd werd bereikt en de scherpe vertraging in de theoretische natuurwetenschappen.
Aan het begin van de 17e eeuw verschenen er belangrijke filosofische werken die een aanzienlijke impact hadden op de ontwikkeling van de natuurwetenschappen. De Engelse filosoof Francis Bacon bracht de stelling naar voren dat het doorslaggevende argument in een wetenschappelijke discussie het experiment zou moeten zijn. De zeventiende eeuw werd in de filosofie ook gekenmerkt door de heropleving van atomistische ideeën. Wiskundige (grondlegger van de analytische meetkunde) en filosoof René Descartes voerden aan dat alle lichamen bestaan uit bloedlichaampjes van verschillende vormen en maten; de vorm van de bloedlichaampjes houdt verband met de eigenschappen van de stof. Tegelijkertijd geloofde Descartes dat bloedlichaampjes deelbaar zijn en uit één enkele materie bestaan. Descartes ontkende de ideeën van Democritus over ondeelbare atomen die in leegte bewegen, en durfde het bestaan van leegte niet toe te geven. Corpusculaire ideeën, die zeer dicht bij de oude ideeën van Epicurus liggen, werden ook uitgedrukt door de Franse filosoof Pierre Gassendi. Gassendi noemde groepen atomen die samengestelde moleculen vormen (van lat. moedervlekken- een bos). Gassendi's corpusculaire concepten hebben vrij brede erkenning gekregen onder natuurwetenschappers.
In de 17e eeuw werd de nieuwe experimentele natuurwetenschap een instrument om de tegenstelling tussen een hoog technologieniveau en een extreem laag kennisniveau over de natuur op te lossen.
Een van de gevolgen van de wetenschappelijke revolutie die plaatsvond in de tweede helft van de 17e eeuw was de creatie van een nieuwe wetenschappelijke chemie. Robert Boyle wordt traditioneel beschouwd als de schepper van de wetenschappelijke chemie, die de inconsistentie van alchemistische ideeën bewees, de eerste wetenschappelijke definitie gaf van het concept van een chemisch element en daarmee de chemie voor het eerst naar het niveau van de wetenschap verhief.
De Britse wetenschapper Robert Boyle was een van de grootste scheikundigen, natuurkundigen en filosofen van zijn tijd. Boyle's belangrijkste wetenschappelijke prestaties op het gebied van de scheikunde omvatten zijn basis van analytische chemie (kwalitatieve analyse), onderzoek naar de eigenschappen van zuren, de introductie van indicatoren in de chemische praktijk en de studie van de dichtheden van vloeistoffen met behulp van de hydrometer die hij heeft uitgevonden. Het is onmogelijk om de door Boyle ontdekte wet, die zijn naam draagt (ook wel de Boyle-Mariotte-wet genoemd), niet te noemen.
De belangrijkste verdienste van Boyle was echter zijn voorgestelde nieuwe systeem van chemische filosofie, uiteengezet in het boek “The Skeptical Chemist” (1661). Het boek was gewijd aan het zoeken naar een antwoord op de vraag wat precies als elementen moet worden beschouwd, gebaseerd op het huidige ontwikkelingsniveau van de chemie. Boyle schreef:
“Chemici hebben zich tot nu toe laten leiden door te beperkte principes die geen bijzonder brede mentale kijk vereisten; Zij zagen hun taak in de bereiding van medicijnen, in de productie en transformatie van metalen. Ik bekijk de scheikunde vanuit een heel ander perspectief: niet als een arts, niet als een alchemist, maar zoals een filosoof ernaar zou moeten kijken. Ik heb hier een plan voor de chemische filosofie geschetst, dat ik hoop uit te voeren en te verbeteren met mijn experimenten en observaties..
Het boek is gestructureerd in de vorm van een gesprek tussen vier filosofen: Themist, een peripateticus (volgeling van Aristoteles), Philoponus, een spagyricist (aanhanger van Paracelsus), Carneades, die de opvattingen uiteenzet van ‘Mr. die op onpartijdige wijze de argumenten van de disputanten beoordeelt. De discussie over filosofen bracht de lezer tot de conclusie dat noch de vier elementen van Aristoteles, noch de drie principes van de alchemisten als elementen kunnen worden herkend. Boyle benadrukte:
“Er is geen reden om aan een bepaald lichaam de naam van dit of dat element toe te kennen, simpelweg omdat het er op lijkt in een gemakkelijk waarneembare eigenschap; met hetzelfde recht zou ik het deze naam kunnen weigeren, omdat andere eigenschappen anders zijn.”.
Op basis van experimentele gegevens toonde Boyle aan dat de concepten van de moderne chemie moeten worden herzien en in overeenstemming moeten worden gebracht met het experiment.
Elementen zijn volgens Boyle vrijwel onafbreekbare lichamen (stoffen), bestaande uit soortgelijke homogene (bestaande uit primaire materie) bloedlichaampjes, waaruit alle complexe lichamen zijn samengesteld en waarin ze kunnen worden ontleed. Bloedlichaampjes kunnen variëren in vorm, grootte en massa. De bloedlichaampjes waaruit lichamen worden gevormd, blijven onveranderd tijdens de transformaties van laatstgenoemde.
Boyle zag de hoofdtaak van de scheikunde in de studie van de samenstelling van stoffen en de afhankelijkheid van de eigenschappen van een stof van de samenstelling ervan. Tegelijkertijd achtte Boyle het mogelijk om het concept van compositie alleen te gebruiken als het mogelijk is om het oorspronkelijke lichaam te herstellen uit de elementen die geïsoleerd zijn uit een bepaald complex lichaam (dat wil zeggen, hij nam feitelijk synthese als criterium voor de juistheid van de analyse ). Boyle noemde in zijn geschriften geen enkel element in het nieuwe begrip van dit concept; Hij gaf het aantal elementen niet aan, maar merkte alleen op dat:
"Het zou niet absurd zijn om aan te nemen dat het aantal veel meer is dan drie of vier".
Het boek “The Skeptical Chemist” is dus geen antwoord op prangende vragen uit de chemische filosofie, maar het stellen van een nieuw doel voor de scheikunde. De belangrijkste betekenis van Boyle's werk is dit:
1. Formulering van een nieuw doel van de chemie: het bestuderen van de samenstelling van stoffen en de afhankelijkheid van de eigenschappen van een stof van de samenstelling ervan.
2. Voorstel van een programma voor het zoeken en bestuderen van echte chemische elementen;
3. Inleiding tot de chemie van de inductieve methode;
Boyle's ideeën over het element als een vrijwel onafbreekbare substantie kregen al snel brede acceptatie onder natuurwetenschappers. Het creëren van theoretische ideeën over de samenstelling van lichamen die de leringen van Aristoteles en de kwik-zwaveltheorie kunnen vervangen, bleek echter een zeer moeilijke taak. In het laatste kwart van de 17e eeuw verschenen eclectische opvattingen, waarvan de makers probeerden alchemistische tradities en nieuwe ideeën over chemische elementen met elkaar te verbinden. De opvattingen van de Franse scheikundige Nicolas Lemery, auteur van het bekende leerboek ‘Course of Chemistry’, hadden een grote invloed op zijn tijdgenoten.
Lemery's leerboek begon met een definitie van het onderwerp scheikunde:
“Chemie is een kunst die leert hoe je verschillende stoffen in gemengde lichamen kunt scheiden. Onder gemengde lichamen versta ik de stoffen die in de natuur worden gevormd, namelijk: mineralen, plantaardige en dierlijke lichamen.”.
Vervolgens somde Lemery de ‘chemische principes’ op, dat wil zeggen de belangrijkste componenten van lichamen. Na een bepaalde ‘universele geest’ (waarvan de auteur zelf toegeeft dat deze ‘enigszins metafysisch’ is), identificeerde Lemery, gebaseerd op analyse door middel van vuur, vijf materiële basisprincipes van substanties: alcohol (anders ‘kwik’), olie (anders ‘zwavel’). ”), zout, water ("slijm") en aarde. De eerste drie principes zijn actief, water en aarde zijn passief.
Lemery merkte echter op dat deze stoffen voor ons slechts een ‘begin’ zijn voor zover scheikundigen niet in staat zijn deze lichamen verder te ontbinden; Het is duidelijk dat dit “begin” op zijn beurt kan worden onderverdeeld in eenvoudigere. Wat dus als principes wordt aanvaard, zijn de stoffen die worden verkregen door de scheiding van gemengde lichamen en die alleen worden gescheiden voor zover de middelen waarover scheikundigen beschikken dit toelaten.
Aan het begin van de 17e en 18e eeuw stond de wetenschappelijke chemie nog maar aan het begin van haar reis; De belangrijkste obstakels die moesten worden overwonnen waren nog steeds sterke alchemistische tradities (noch Boyle noch Lemery ontkenden de fundamentele mogelijkheid van transmutatie), valse ideeën over het afvuren van metalen als ontbinding, en de speculatieve (speculatieve) aard van het atomisme.
De filosofie van de 18e eeuw is een filosofie van de geest, de rede en het wetenschappelijk denken. De menselijke geest probeert de wereld om ons heen te begrijpen met behulp van wetenschappelijke kennis, overwegingen, observaties en logische conclusies, in tegenstelling tot middeleeuwse scholastiek en het blindelings vasthouden aan kerkelijke dogma's. Dit had ook invloed op de chemie. De eerste theorieën over de wetenschappelijke chemie begonnen te verschijnen.
De eerste theorie van de wetenschappelijke scheikunde – de theorie van flogiston – was grotendeels gebaseerd op traditionele ideeën over de samenstelling van stoffen en over elementen als dragers van bepaalde eigenschappen. Niettemin was zij het die in de 18e eeuw de belangrijkste voorwaarde en de belangrijkste drijvende kracht werd voor de ontwikkeling van de leer van de elementen en bijdroeg aan de volledige bevrijding van de chemie van de alchemie. Het was tijdens het bijna een eeuw durende bestaan van de flogistontheorie dat de transformatie van alchemie in scheikunde, begonnen door Boyle, werd voltooid.
De phlogistontheorie van verbranding werd gecreëerd om de processen van het bakken van metalen te beschrijven, waarvan de studie aan het einde van de 18e eeuw een van de belangrijkste problemen in de chemie was. De metallurgie werd in die tijd geconfronteerd met twee problemen, waarvan de oplossing onmogelijk was zonder serieus wetenschappelijk onderzoek: grote verliezen bij het smelten van metalen en de brandstofcrisis veroorzaakt door de bijna volledige vernietiging van bossen in Europa.
De basis voor de theorie van flogiston was het traditionele idee van verbranding als de ontbinding van een lichaam. Het fenomenologische beeld van het bakken van metalen was algemeen bekend: het metaal verandert in schaal, waarvan de massa groter is dan de massa van het oorspronkelijke metaal; Bovendien komen tijdens de verbranding gasvormige producten van onbekende aard vrij. Het doel van de chemische theorie was een rationele verklaring van dit fenomeen, die gebruikt kon worden om specifieke technische problemen op te lossen. Noch de ideeën van Aristoteles, noch de alchemistische opvattingen over verbranding voldeden aan de laatste voorwaarde.
De makers van de phlogistontheorie worden beschouwd als de Duitse chemici Johann Joachim Becher en Georg Ernst Stahl. Becher schetste in zijn boek "Underground Physics" zijn zeer eclectische opvattingen over de samenstellende delen van lichamen. Dit zijn naar zijn mening drie soorten aarde: de eerste is smeltbaar en rotsachtig (terra lapidea), de tweede is vettig en brandbaar (terra pinguis) en de derde is vluchtig (terra fluda s. mercurialis). De ontvlambaarheid van lichamen is volgens Becher te wijten aan de aanwezigheid van een tweede, vette aarde in hun samenstelling. Het systeem van Becher lijkt sterk op de alchemistische leer van de drie principes, waarin ontvlambaarheid te wijten is aan de aanwezigheid van zwavel; Becher gelooft echter dat zwavel een complex lichaam is dat wordt gevormd door zuur en terra pinguis. In feite vertegenwoordigde Bechers theorie een van de eerste pogingen om iets nieuws aan te bieden ter vervanging van de alchemistische leer van de drie principes. Becher verklaarde traditioneel de toename van de metaalmassa tijdens het bakken door de toevoeging van ‘vurige materie’. Deze opvattingen van Becher dienden als voorwaarde voor de totstandkoming van de flogistontheorie die Stahl in 1703 voorstelde, hoewel ze er weinig mee gemeen hebben. Stahl zelf beweerde echter altijd dat de auteur van de theorie van Becher is.
De essentie van de flogistontheorie kan worden samengevat in de volgende basisprincipes:
1. In alle brandbare lichamen zit een materiële substantie: phlogiston (van het Griekse φλογιστοζ - brandbaar).
2. Verbranding is de ontbinding van een lichaam waarbij flogiston vrijkomt, dat onomkeerbaar in de lucht wordt verspreid. De draaikolkachtige bewegingen van flogiston die vrijkomen uit een brandend lichaam vertegenwoordigen zichtbaar vuur. Alleen planten kunnen flogiston uit de lucht halen.
3. Phlogiston wordt altijd gecombineerd met andere stoffen en kan in zuivere vorm niet geïsoleerd worden; De stoffen die het rijkst zijn aan flogiston zijn de stoffen die branden zonder een residu achter te laten.
4. Phlogiston heeft een negatieve massa.
De theorie van Stahl was, net als al zijn voorgangers, ook gebaseerd op het idee dat de eigenschappen van een stof worden bepaald door de aanwezigheid daarin van een speciale drager van deze eigenschappen. Het standpunt van de flogistontheorie over de negatieve massa van flogiston was bedoeld om het feit te verklaren dat de massa van de schaal (of alle verbrandingsproducten, inclusief gasvormige) groter is dan de massa van het verbrande metaal.
Het proces van het bakken van een metaal binnen het raamwerk van de flogistontheorie kan worden weergegeven door de volgende soortgelijke chemische vergelijking:
Metaal = Schaal + Phlogiston
Om metaal uit kalk (of erts) te verkrijgen, kun je volgens de theorie elk lichaam gebruiken dat rijk is aan flogiston (dat wil zeggen, brandt zonder residu) - houtskool of steenkool, vet, plantaardige olie, enz.:
Schaal + Phlogiston-rijk lichaam = Metaal
Benadrukt moet worden dat experimenten de geldigheid van deze veronderstelling alleen maar kunnen bevestigen; dit was een goed argument ten gunste van de theorie van Stahl. De flogistontheorie werd uiteindelijk uitgebreid tot alle verbrandingsprocessen. De identiteit van flogiston in alle brandbare lichamen werd door Stahl experimenteel onderbouwd: steenkool reduceert zwavelzuur in gelijke mate tot zwavel en aarde tot metalen. Ademhaling en roesten van ijzer vertegenwoordigen volgens de volgelingen van Stahl hetzelfde proces van ontbinding van lichamen die flogiston bevatten, maar verlopen langzamer dan verbranding.
De phlogistontheorie maakte het in het bijzonder mogelijk om een aanvaardbare verklaring te geven voor de processen van het smelten van metalen uit erts, die uit het volgende bestaat: erts, dat weinig phlogiston bevat, wordt verwarmd met houtskool, dat zeer rijk is aan phlogiston; In dit geval gaat flogiston over van steenkool naar erts, en worden flogistonrijk metaal en flogistonarme as gevormd.
Opgemerkt moet worden dat er in de historische literatuur ernstige meningsverschillen bestaan over de beoordeling van de rol van de phlogistontheorie - van scherp negatief tot positief. Het kan echter niet worden ontkend dat de flogistontheorie een aantal onbetwiste voordelen had:
– het beschrijft eenvoudig en adequaat experimentele feiten met betrekking tot verbrandingsprocessen;
– de theorie is intern consistent, d.w.z. geen van de gevolgen is in tegenspraak met de belangrijkste bepalingen;
– de theorie van flogiston is volledig gebaseerd op experimentele feiten;
– de flogistontheorie had een voorspellend vermogen.
De flogistontheorie, de eerste echt wetenschappelijke theorie van de scheikunde, diende als een krachtige stimulans voor de ontwikkeling van kwantitatieve analyse van complexe lichamen, zonder welke experimentele bevestiging van ideeën over chemische elementen absoluut onmogelijk zou zijn geweest. Opgemerkt moet worden dat de uitspraak over de negatieve massa van flogiston feitelijk werd gedaan op basis van de wet van behoud van massa, die veel later werd ontdekt. Deze veronderstelling droeg op zichzelf al bij aan de verdere intensivering van kwantitatief onderzoek. Een ander resultaat van de creatie van de flogistontheorie was de actieve studie door chemici van gassen in het algemeen en gasvormige verbrandingsproducten in het bijzonder. Tegen het midden van de 18e eeuw werd pneumatische chemie een van de belangrijkste takken van de chemie, waarvan de oprichters Joseph Black, Daniel Rutherford, Henry Cavendish, Joseph Priestley en Karl Wilhelm Scheele de makers waren van een heel systeem van kwantitatieve methoden in de chemie.
In de tweede helft van de 18e eeuw kreeg de flogistontheorie bijna universele erkenning onder scheikundigen. Gebaseerd op flogistonconcepten werd een nomenclatuur van stoffen gevormd; Er zijn pogingen ondernomen om eigenschappen van een stof, zoals kleur, transparantie, alkaliteit, enz., in verband te brengen met het gehalte aan flogiston daarin. De Franse chemicus Pierre Joseph Maceur, auteur van het zeer populaire leerboek "Elements of Chemistry" en "Chemical Dictionary", schreef in 1778 dat de phlogistontheorie
"... is de duidelijkste en meest consistente met chemische verschijnselen. Stahl's theorie verschilt van systemen die zijn gegenereerd door de verbeelding zonder overeenstemming met de natuur en vernietigd door ervaring, en is de meest betrouwbare gids in chemisch onderzoek. Talrijke experimenten... zijn niet alleen ver van het weerleggen ervan, maar wordt integendeel een bewijs in haar voordeel’.
Ironisch genoeg verschenen Maceurs handboek en woordenboek in een tijd waarin het tijdperk van de flogistontheorie ten einde liep.
Niet-flogiston-ideeën over verbranding en ademhaling ontstonden zelfs iets eerder dan de flogiston-theorie. Jean Rey, aan wie de wetenschap het postulaat ‘alle lichamen zijn zwaar’ te danken heeft, suggereerde al in 1630 dat de toename van de metaalmassa tijdens het bakken te wijten was aan de toevoeging van lucht. In 1665 suggereerde Robert Hooke in zijn werk 'Micrography' ook de aanwezigheid in de lucht van een speciale substantie die lijkt op de substantie die in gebonden toestand in salpeter zit.
Deze opvattingen werden verder ontwikkeld in het boek ‘On salpeter and airborne alcohol of salpeter’, dat in 1669 werd geschreven door de Engelse chemicus John Mayow. Mayow probeerde te bewijzen dat de lucht een speciaal gas bevat (spiritus nitroaëreus) dat de verbranding ondersteunt en noodzakelijk is om te ademen; Deze veronderstelling onderbouwde hij met beroemde experimenten met een brandende kaars onder een bel. Het was echter pas na ruim honderd jaar mogelijk deze spiritus nitroaëreus in een vrije staat te isoleren. De ontdekking van zuurstof werd onafhankelijk van elkaar vrijwel gelijktijdig door verschillende wetenschappers gedaan.
Karl Wilhelm Scheele verkreeg in 1771 zuurstof en noemde het ‘vurige lucht’; de resultaten van Scheele's experimenten werden echter pas in 1777 gepubliceerd. Volgens Scheele was de 'vurige lucht' 'een zure dunne materie gecombineerd met flogiston'.
Joseph Priestley isoleerde zuurstof in 1774 door kwikoxide te verwarmen. Priestley geloofde dat het gas dat hij verkreeg lucht was die volledig verstoken was van flogiston, waardoor de verbranding in deze ‘gedeflogiseerde lucht’ beter verliep dan in gewone lucht.
Bovendien was de ontdekking van waterstof door Cavendish in 1766 en stikstof door Rutherford in 1772 (opgemerkt moet worden dat Cavendish waterstof aanzag voor puur flogiston) van groot belang voor het ontstaan van de zuurstoftheorie van verbranding.
De betekenis van de ontdekking van Scheele en Priestley kon correct worden beoordeeld door de Franse chemicus Antoine Laurent Lavoisier. In 1774 publiceerde Lavoisier de verhandeling ‘Small Works on Physics and Chemistry’, waarin hij suggereerde dat tijdens verbranding een deel van de atmosferische lucht aan lichamen wordt toegevoegd. Nadat Priestley in 1774 Parijs had bezocht en Lavoisier had verteld over de ontdekking van ‘gedeflogiseerde lucht’, herhaalde Lavoisier zijn experimenten en in 1775 publiceerde hij het werk ‘Over de aard van een stof die zich combineert met metalen wanneer deze wordt gecalcineerd en hun gewicht verhoogt’ (maar Lavoisier schreef de prioriteit van de ontdekking van zuurstof aan zichzelf toe). Ten slotte formuleerde Lavoisier in 1777 de basisprincipes van de zuurstoftheorie van verbranding:
1. Lichamen verbranden alleen in ‘schone lucht’.
2. Tijdens de verbranding wordt "schone lucht" geabsorbeerd en de toename van de massa van het verbrande lichaam is gelijk aan de afname van de luchtmassa.
3. Bij verhitting veranderen metalen in ‘aarden’. Zwavel of fosfor verandert, in combinatie met “schone lucht”, in zuren.
De nieuwe zuurstoftheorie van verbranding (de term zuurstof – oxygenium – verscheen in 1877 in Lavoisiers werk ‘Algemene overweging van de aard van zuren en de principes van hun combinatie’) had een aantal belangrijke voordelen ten opzichte van de flogistische theorie. Het is eenvoudiger dan het phlogiston-model, bevatte geen ‘onnatuurlijke’ aannames over de aanwezigheid van negatieve massa in lichamen, en, belangrijker nog, was niet gebaseerd op het bestaan van stoffen die niet experimenteel zijn geïsoleerd. Als gevolg hiervan kreeg de zuurstoftheorie van verbranding snel brede acceptatie onder natuurwetenschappers (hoewel de controverse tussen Lavoisier en de flogistiek vele jaren voortduurde).
Aan het einde van de 18e eeuw en het begin van de 19e eeuw heerste er in de filosofie een beweging genaamd Scientism (van de wetenschap), die zich manifesteert in bewondering voor de wetenschap, de cultus van de wetenschap en de menselijke kennis. Een persoon is trots op zijn kennis en intelligentie, vrijheid en heeft vertrouwen in zijn vermogen om alle problemen die zich voordoen op te lossen. Academies werden de belangrijkste centra van wetenschappelijke activiteit. Op dat moment vond er een revolutie plaats in de chemische wetenschap.
De betekenis van de zuurstoftheorie bleek veel groter dan alleen een verklaring van de verschijnselen verbranding en ademhaling. De verwerping van de flogistontheorie vereiste een herziening van alle basisprincipes en concepten van de chemie, een verandering in de terminologie en de nomenclatuur van stoffen. Daarom begon met de creatie van de zuurstoftheorie een keerpunt in de ontwikkeling van de chemie, genaamd de ‘chemische revolutie’.
In 1785-1787 Vier vooraanstaande Franse chemici - Antoine Laurent Lavoisier, Claude Louis Berthollet, Louis Bernard Guiton de Morveau en Antoine Francois de Fourcroy - ontwikkelden namens de Parijse Academie van Wetenschappen een nieuw systeem van chemische nomenclatuur. De logica van de nieuwe nomenclatuur omvatte het construeren van de naam van een stof op basis van de namen van de elementen waaruit de stof bestaat. De basisprincipes van deze nomenclatuur worden nog steeds gebruikt.
Een periode is een rij van het periodieke systeem van chemische elementen, een reeks atomen in volgorde van toenemende nucleaire lading en het vullen van de buitenste elektronenschil met elektronen.
Het periodiek systeem heeft zeven perioden. De eerste periode, die twee elementen bevat, en de tweede en derde, die elk acht elementen bevatten, worden klein genoemd. De overige perioden met 18 of meer elementen zijn groot. De zevende periode is niet voltooid. Het nummer van de periode waartoe een chemisch element behoort, wordt bepaald door het aantal elektronenschillen.
Elke periode begint met een typisch metaal en eindigt met een edelgas, voorafgegaan door een typisch niet-metaal.
In de eerste periode is er naast helium slechts één element: waterstof, dat eigenschappen combineert die typerend zijn voor zowel metalen als niet-metalen. De 1s-subshell van deze elementen is gevuld met elektronen.
Voor elementen uit de tweede en derde periode worden de s- en p-subshells opeenvolgend gevuld. Elementen met een korte periode worden gekenmerkt door een vrij snelle toename van de elektronegativiteit met toenemende nucleaire ladingen, een verzwakking van de metallische eigenschappen en een toename van niet-metalen eigenschappen.
De vierde en vijfde periode bevatten decennia van overgangs-d-elementen, waarin, na het vullen van de buitenste s-subshell met elektronen, de d-subshell van het vorige energieniveau wordt gevuld, volgens de Klechkovsky-regel.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 6f 7d 7f ...
In de zesde en zevende periode raken de 4f- en 5f-subshells verzadigd, waardoor ze 14 elementen meer bevatten vergeleken met de 4e en 5e periode.
Vanwege de verschillen in lengte van perioden en andere kenmerken, zijn er verschillende manieren om ze relatief in het periodieke systeem te rangschikken. In de korteperiodeversie bevatten korte perioden één rij elementen, terwijl grote perioden twee rijen bevatten. In de lange-periodeversie bestaan alle periodes uit één reeks. De lanthanide- en actinidereeksen worden meestal afzonderlijk onderaan de tabel vermeld.
Elementen uit dezelfde periode hebben vergelijkbare atoommassa's, maar verschillende fysische en chemische eigenschappen, in tegenstelling tot elementen van dezelfde groep. Met een toename van de nucleaire lading van elementen uit dezelfde periode neemt de atoomstraal af en neemt het aantal valentie-elektronen toe, waardoor de metallische en niet-metallische eigenschappen van de elementen worden verzwakt, de reducerende eigenschappen worden verzwakt en de oxidatieve eigenschappen van de stoffen die ze vormen worden versterkt.
Als u het periodiek systeem moeilijk te begrijpen vindt, bent u niet de enige! Hoewel het moeilijk kan zijn om de principes ervan te begrijpen, zal het leren gebruiken ervan je helpen bij het bestuderen van wetenschap. Bestudeer eerst de structuur van de tabel en welke informatie u daaruit kunt leren over elk chemisch element. Vervolgens kunt u beginnen met het bestuderen van de eigenschappen van elk element. En ten slotte kun je met behulp van het periodiek systeem het aantal neutronen in een atoom van een bepaald chemisch element bepalen.
Stappen
Deel 1
Tabelstructuur-
De elementen in de tabel zijn van links naar rechts gerangschikt in oplopende volgorde van hun atoomnummer. Het atoomnummer geeft aan hoeveel protonen er in één atoom zitten. Bovendien neemt de atoommassa toe naarmate het atoomnummer toeneemt. Door de locatie van een element in het periodiek systeem kan dus de atoommassa ervan worden bepaald. Zoals je kunt zien, bevat elk volgend element één proton meer dan het element dat eraan voorafgaat.
- Dit wordt duidelijk als je naar de atoomnummers kijkt. De atoomnummers worden met één verhoogd als je van links naar rechts beweegt. Omdat elementen in groepen zijn gerangschikt, blijven sommige tabelcellen leeg.
-
De eerste rij van de tabel bevat bijvoorbeeld waterstof, dat atoomnummer 1 heeft, en helium, dat atoomnummer 2 heeft. Ze bevinden zich echter aan tegenovergestelde randen omdat ze tot verschillende groepen behoren. Leer meer over groepen die elementen bevatten met vergelijkbare fysische en chemische eigenschappen.
- De elementen van elke groep bevinden zich in de overeenkomstige verticale kolom. Ze worden doorgaans geïdentificeerd door dezelfde kleur, waardoor elementen met vergelijkbare fysische en chemische eigenschappen kunnen worden geïdentificeerd en hun gedrag kan worden voorspeld. Alle elementen van een bepaalde groep hebben hetzelfde aantal elektronen in hun buitenste schil.
- Waterstof kan worden geclassificeerd als zowel alkalimetalen als halogenen. In sommige tabellen wordt dit in beide groepen aangegeven.
- In de meeste gevallen zijn de groepen genummerd van 1 tot en met 18 en worden de nummers bovenaan of onderaan de tafel geplaatst. Getallen kunnen worden opgegeven in Romeinse (bijvoorbeeld IA) of Arabische (bijvoorbeeld 1A of 1) cijfers.
-
Wanneer u van boven naar beneden door een kolom beweegt, wordt er gezegd dat u ‘door een groep bladert’. Ontdek waarom er lege cellen in de tabel staan.
- Elementen zijn niet alleen geordend op basis van hun atoomnummer, maar ook op groep (elementen in dezelfde groep hebben vergelijkbare fysische en chemische eigenschappen). Dankzij dit is het gemakkelijker om te begrijpen hoe een bepaald element zich gedraagt. Naarmate het atoomnummer toeneemt, worden elementen die in de overeenkomstige groep vallen echter niet altijd gevonden, waardoor er lege cellen in de tabel verschijnen.
- Elementen met atoomnummers 57 tot en met 102 worden geclassificeerd als zeldzame aardelementen en worden meestal in hun eigen subgroep in de rechter benedenhoek van de tabel geplaatst.
-
Elke rij van de tabel vertegenwoordigt een periode. Alle elementen uit dezelfde periode hebben hetzelfde aantal atomaire orbitalen waarin de elektronen in de atomen zich bevinden. Het aantal orbitalen komt overeen met het periodenummer. De tabel bevat 7 rijen, dat wil zeggen 7 perioden.
- Atomen van elementen uit de eerste periode hebben bijvoorbeeld één orbitaal, en atomen van elementen uit de zevende periode hebben 7 orbitalen.
- In de regel worden perioden aangegeven met cijfers van 1 tot en met 7 aan de linkerkant van de tabel.
- Terwijl u langs een lijn van links naar rechts beweegt, wordt gezegd dat u ‘de periode scant’.
-
Leer onderscheid te maken tussen metalen, metalloïden en niet-metalen. Je begrijpt de eigenschappen van een element beter als je kunt bepalen welk type het is. Voor het gemak worden metalen, metalloïden en niet-metalen in de meeste tabellen met verschillende kleuren aangeduid. Metalen bevinden zich aan de linkerkant en niet-metalen aan de rechterkant van de tafel. Metalloïden bevinden zich ertussen.
Deel 2
Elementaanduidingen-
Elk element wordt aangeduid met een of twee Latijnse letters. In de regel wordt het elementsymbool in grote letters in het midden van de overeenkomstige cel weergegeven. Een symbool is een verkorte naam voor een element dat in de meeste talen hetzelfde is. Elementsymbolen worden vaak gebruikt bij het uitvoeren van experimenten en het werken met chemische vergelijkingen, dus het is handig om ze te onthouden.
- Elementsymbolen zijn doorgaans afkortingen van hun Latijnse naam, hoewel ze voor sommige, vooral recent ontdekte elementen, zijn afgeleid van de algemene naam. Helium wordt bijvoorbeeld weergegeven door het symbool He, dat in de meeste talen dicht bij de algemene naam ligt. Tegelijkertijd wordt ijzer aangeduid als Fe, wat een afkorting is van de Latijnse naam.
-
Let op de volledige naam van het element als deze in de tabel wordt vermeld. Dit element "naam" wordt gebruikt in reguliere teksten. 'Helium' en 'koolstof' zijn bijvoorbeeld namen van elementen. Meestal, hoewel niet altijd, worden de volledige namen van de elementen vermeld onder hun chemische symbool.
- Soms geeft de tabel niet de namen van de elementen aan, maar alleen hun chemische symbolen.
-
Zoek het atoomnummer. Meestal bevindt het atoomnummer van een element zich bovenaan de overeenkomstige cel, in het midden of in de hoek. Het kan ook verschijnen onder het symbool of de naam van het element. Elementen hebben atoomnummers van 1 tot en met 118.
- Het atoomnummer is altijd een geheel getal.
-
Bedenk dat het atoomnummer overeenkomt met het aantal protonen in een atoom. Alle atomen van een element bevatten hetzelfde aantal protonen. In tegenstelling tot elektronen blijft het aantal protonen in de atomen van een element constant. Anders zou je een ander chemisch element krijgen!
- Het atoomnummer van een element kan ook het aantal elektronen en neutronen in een atoom bepalen.
-
Meestal is het aantal elektronen gelijk aan het aantal protonen. De uitzondering is het geval wanneer het atoom geïoniseerd is. Protonen hebben een positieve lading en elektronen hebben een negatieve lading. Omdat atomen meestal neutraal zijn, bevatten ze hetzelfde aantal elektronen en protonen. Een atoom kan echter elektronen winnen of verliezen, in welk geval het geïoniseerd raakt.
- Ionen hebben een elektrische lading. Als een ion meer protonen heeft, heeft het een positieve lading. In dat geval wordt er een plusteken achter het elementsymbool geplaatst. Als een ion meer elektronen bevat, heeft het een negatieve lading, aangegeven door een minteken.
- De plus- en mintekens worden niet gebruikt als het atoom geen ion is.
-
Het periodiek systeem, of het periodiek systeem van chemische elementen, begint in de linkerbovenhoek en eindigt aan het einde van de laatste rij van de tabel (rechteronderhoek).
Een periode is een rij van het periodieke systeem van chemische elementen, een reeks atomen in volgorde van toenemende nucleaire lading en het vullen van de buitenste elektronenschil met elektronen.
Het periodiek systeem heeft zeven perioden. De eerste periode, die twee elementen bevat, en de tweede en derde, die elk acht elementen bevatten, worden klein genoemd. De overige perioden met 18 of meer elementen zijn groot. De zevende periode is niet voltooid. Het nummer van de periode waartoe een chemisch element behoort, wordt bepaald door het aantal elektronenschillen (energieniveaus).
Het ladingsnummer van de atoomkern (synoniemen: atoomnummer, atoomnummer, rangnummer van een chemisch element) is het aantal protonen in de atoomkern. Het ladingsgetal is gelijk aan de lading van de kern in eenheden van elementaire lading en tegelijkertijd gelijk aan het serienummer van het chemische element dat overeenkomt met de kern in het periodiek systeem.
Een groep van het periodieke systeem van chemische elementen is een reeks atomen in toenemende nucleaire lading die dezelfde elektronische structuur hebben.
In de kortetermijnversie van het periodieke systeem zijn de groepen verdeeld in subgroepen: hoofd (of subgroepen A), beginnend met elementen van de eerste en tweede periode, en secundaire (subgroepen B), die d-elementen bevatten. Subgroepen worden ook genoemd naar het element met de laagste kernlading (meestal het element van de tweede periode voor de hoofdsubgroepen en het element van de vierde periode voor secundaire subgroepen). Elementen van dezelfde subgroep hebben vergelijkbare chemische eigenschappen.
wat is een periode in de chemie
- Periode is een rij van het periodieke systeem van chemische elementen, een reeks atomen in volgorde van toenemende nucleaire lading en het vullen van de buitenste elektronenschil met elektronen.
Het periodiek systeem heeft zeven perioden. De eerste periode, die twee elementen bevat, en de tweede en derde, die elk acht elementen bevatten, worden klein genoemd. De overige perioden met 18 of meer elementen zijn groot. De zevende periode is niet voltooid. Het nummer van de periode waartoe een chemisch element behoort, wordt bepaald door het aantal elektronenschillen (energieniveaus).
Elke periode (behalve de eerste) begint met een typisch metaal (Li, Na, K, Rb, Cs, Fr) en eindigt met een edelgas (He, Ne, Ar, Kr, Xe, Rn), dat wordt voorafgegaan door een typisch niet-metaal.
Dageraad#769;datum#769; atoomkern (synoniemen: atoomnummer, atoomnummer, atoomnummer van een chemisch element) het aantal protonen in een atoomkern. Het ladingsgetal is gelijk aan de lading van de kern in eenheden van elementaire lading en tegelijkertijd gelijk aan het serienummer van het chemische element dat overeenkomt met de kern in het periodiek systeem.
Een groep van het periodieke systeem van chemische elementen is een reeks atomen in toenemende nucleaire lading die hetzelfde type elektronische structuur hebben.
Het groepsnummer wordt bepaald door het aantal elektronen in de buitenste schil van het atoom (valentie-elektronen) en komt in de regel overeen met de hoogste valentie van het atoom.
In de kortetermijnversie van het periodieke systeem zijn de groepen verdeeld in hoofdsubgroepen (of subgroepen A), te beginnen met elementen uit de eerste en tweede periode, en secundaire (subgroepen B), die d-elementen bevatten. Subgroepen worden ook genoemd naar het element met de laagste nucleaire lading (meestal het element uit de tweede periode voor de hoofdsubgroepen en het element uit de vierde periode voor de secundaire subgroepen). Elementen van dezelfde subgroep hebben vergelijkbare chemische eigenschappen.
Met een toename van de nucleaire lading van elementen van dezelfde groep, als gevolg van een toename van het aantal elektronenschillen, nemen de atoomstralen toe, wat resulteert in een afname van de elektronegativiteit, een toename van de metallische eigenschappen en een verzwakking van de niet-metallische eigenschappen van de elementen, een toename van de reductie en verzwakking van de oxidatieve eigenschappen van de stoffen die ze vormen.
- Horizontale rijen in de tabel. Mendelejev
- Horizontale lijn (ta sho zleva) tafel. Mendelev
Evolutie van het periodiek systeem van chemische elementen
Het door Mendelejev geïntroduceerde idee over de plaats van een element in het systeem bleek bijzonder en belangrijk voor de evolutie van het periodieke systeem van chemische elementen; De positie van het element wordt bepaald door de periode- en groepsnummers. Op basis van dit idee kwam Mendelejev tot de conclusie dat het noodzakelijk was om de toen geaccepteerde atoomgewichten van sommige elementen (U, In, Ce en zijn analogen) te veranderen, wat de eerste praktische toepassing van atoomgewichten was. e., en voorspelde ook voor het eerst het bestaan en de basiseigenschappen van verschillende onbekende elementen, die overeenkwamen met de lege cellen van P. s. e. Een klassiek voorbeeld is de voorspelling van ‘ekaaluminum’ (toekomstige Ga, ontdekt door P. Lecoq de Boisbaudran in 1875), ‘ecaboron’ (Sc, ontdekt door de Zweedse wetenschapper L. Nilsson in 1879) en ‘ekasilicon’ (Ge, ontdekt door de Duitse wetenschapper K. Winkler in 1886). Bovendien voorspelde Mendelejev het bestaan van analogen van mangaan (toekomstige Tc en Re), tellurium (Po), jodium (At), cesium (Fr), barium (Ra), tantaal (Pa).
In veel opzichten vertegenwoordigde het een empirische generalisatie van feiten, aangezien de fysieke betekenis van de periodieke wet onduidelijk was en er geen verklaring was voor de redenen voor de periodieke verandering in de eigenschappen van elementen, afhankelijk van de toename van het atoomgewicht.
dit tot aan de fysische onderbouwing van de periodieke wet en de ontwikkeling van de theorie van P. s. e. veel feiten konden niet worden verklaard. De ontdekking aan het einde van de 19e eeuw was dus onverwacht. inerte gassen, waarvoor geen plaats leek te zijn in P. s. e.; deze moeilijkheid werd geëlimineerd dankzij de opname van p. e. onafhankelijke nulgroep (later VIIIa-subgroep). De ontdekking van veel ‘radio-elementen’ aan het begin van de 20e eeuw. leidde tot een tegenstrijdigheid tussen de noodzaak van hun plaatsing in P. s. e. en de structuur ervan (voor meer dan 30 van dergelijke elementen waren er 7 “vacante” plaatsen in de zesde en zevende periode). Deze tegenstrijdigheid werd overwonnen als resultaat van de ontdekking van isotopen. Ten slotte verloor de waarde van het atoomgewicht (atoommassa) als parameter die de eigenschappen van elementen bepaalt geleidelijk aan zijn betekenis.
Structuur van het periodiek systeem van chemische elementen.
Modern (1975) P. p. e. omvat 106 chemische elementen; Hiervan werden al het transuranium (Z = 93-106), evenals elementen met Z = 43 (Tc), 61 (Pm), 85 (At) en 87 (Fr) kunstmatig verkregen. Door de geschiedenis heen van P. s. e. er werd een groot aantal (enkele honderden) opties voor de grafische weergave voorgesteld, voornamelijk in de vorm van tabellen; Afbeeldingen zijn ook bekend in de vorm van verschillende geometrische figuren (ruimtelijk en vlak), analytische curven (bijvoorbeeld spiralen), enz. Drie vormen van P. komen het meest voor.
e.: kort, voorgesteld door Mendelejev (Fig. 2) en kreeg universele erkenning (in zijn moderne vorm wordt het in de illustratie gegeven); lang (Fig. 3); trap (afb. 4). De lange vorm werd ook ontwikkeld door Mendelejev, en in een verbeterde vorm werd deze in 1905 voorgesteld door A. Werner. De laddervorm werd voorgesteld door de Engelse wetenschapper T. Bailey (1882), de Deense wetenschapper J. Thomsen (1895) en verbeterd door N. Bohr (1921). Elk van de drie vormen heeft voor- en nadelen. Het fundamentele principe van het construeren van P. s. e. is de verdeling van alle chemische elementen in groepen en perioden. Elke groep is op zijn beurt verdeeld in hoofd- (a) en secundaire (b) subgroepen. Elke subgroep bevat elementen met vergelijkbare chemische eigenschappen. Elementen van de a- en b-subgroepen in elke groep vertonen in de regel een zekere chemische gelijkenis met elkaar, voornamelijk in hogere oxidatietoestanden, die in de regel overeenkomen met het groepsnummer. Een periode is een verzameling elementen die begint met een alkalimetaal en eindigt met een inert gas (een speciaal geval is de eerste periode); Elke periode bevat een strikt gedefinieerd aantal elementen. P.S. e. bestaat uit 8 groepen en 7 periodes (de zevende is nog niet afgerond).
Eerste periode van het periodiek systeem der elementen
Het specifieke van de eerste periode is dat deze slechts 2 elementen bevat: H en He. De plaats van H in het systeem is dubbelzinnig: waterstof vertoont eigenschappen die gemeenschappelijk zijn voor alkalimetalen en halogenen; het wordt in de Ia- of (bij voorkeur) in de VIIa-subgroep geplaatst. Helium is de eerste vertegenwoordiger van de VIIa-subgroep (hij en alle inerte gassen werden echter lange tijd gecombineerd tot een onafhankelijke nulgroep).
Tweede periode van het periodiek systeem der elementen
De tweede periode (Li - Ne) bevat 8 elementen. Het begint met het alkalimetaal Li, waarvan de enige oxidatietoestand I is. Dan komt Be, een metaal, de oxidatietoestand van II. Het metallische karakter van het volgende element B komt zwak tot uiting (oxidatietoestand III). De volgende C is een typisch niet-metaal en kan positief of negatief vierwaardig zijn. De volgende N, O, F en Ne zijn niet-metalen, en alleen voor N komt de hoogste oxidatietoestand V overeen met het groepsnummer; zuurstof vertoont slechts zelden een positieve valentie, en voor F is de oxidatietoestand VI bekend. De periode eindigt met het inerte gas Ne.
Derde periode van het periodiek systeem der elementen
De derde periode (Na - Ar) bevat ook 8 elementen, waarvan de aard van de veranderingen in de eigenschappen grotendeels vergelijkbaar is met die waargenomen in de tweede periode. Mg is echter, in tegenstelling tot Be, meer metallisch, net als Al vergeleken met B, hoewel Al inherent amfoteer is. Si, P, S, Cl, Ar zijn typische niet-metalen, maar ze vertonen allemaal (behalve Ar) hogere oxidatietoestanden gelijk aan het groepsnummer. In beide perioden wordt dus, naarmate Z toeneemt, een verzwakking van het metallische karakter en een versterking van het niet-metallische karakter van de elementen waargenomen. Mendelejev noemde de elementen van de tweede en derde periode (klein, in zijn terminologie) typisch. Het is veelbetekenend dat ze tot de meest voorkomende in de natuur behoren, en C, N en O zijn, samen met H, de belangrijkste elementen van organisch materiaal (organogenen). Alle elementen van de eerste drie periodes zijn opgenomen in subgroepen a.
Moderne terminologie - elementen uit deze perioden verwijzen naar s-elementen (alkali- en aardalkalimetalen), componenten van de Ia- en IIa-subgroepen (rood gemarkeerd op de kleurentabel) en p-elementen (B - Ne, At - Ar), opgenomen in de subgroepen IIIa - VIIIa (hun symbolen zijn oranje gemarkeerd). Voor elementen met een kleine periode, met toenemende atoomnummers, wordt eerst een afname van de atoomstralen waargenomen, en wanneer het aantal elektronen in de buitenste schil van het atoom al aanzienlijk toeneemt, leidt hun onderlinge afstoting tot een toename van de atoomstralen. Het volgende maximum wordt bereikt aan het begin van de volgende periode op het alkalische element. Ongeveer hetzelfde patroon is kenmerkend voor ionische stralen.
Vierde periode van het periodiek systeem der elementen
De vierde periode (K - Kr) bevat 18 elementen (de eerste grote periode volgens Mendelejev). Na het alkalimetaal K en de aardalkalimetaal Ca (s-elementen) volgt een reeks van tien zogenaamde overgangselementen (Sc - Zn), of d-elementen (symbolen zijn blauw weergegeven), die zijn opgenomen in subgroepen b van de overeenkomstige groepen van P. s. e. De meeste overgangselementen (die allemaal metalen zijn) vertonen hogere oxidatietoestanden die gelijk zijn aan hun groepsnummer. De uitzondering is de triade Fe - Co - Ni, waarbij de laatste twee elementen maximaal positief driewaardig zijn, en ijzer onder bepaalde omstandigheden bekend is in de oxidatietoestand VI. De elementen, beginnend met Ga en eindigend met Kr (p-elementen), behoren tot subgroepen a, en de aard van de verandering in hun eigenschappen is dezelfde als in de overeenkomstige Z-intervallen voor elementen van de tweede en derde periode. Er is vastgesteld dat Kr chemische verbindingen kan vormen (voornamelijk met F), maar de oxidatietoestand VIII ervan is onbekend.
Vijfde periode van het periodiek systeem der elementen
De vijfde periode (Rb - Xe) is op dezelfde manier opgebouwd als de vierde; het heeft ook een inzetstuk van 10 overgangselementen (Y - Cd), d-elementen. Specifieke kenmerken van de periode: 1) in de triade Ru - Rh - Pd vertoont alleen ruthenium oxidatietoestand VIII; 2) alle elementen van subgroepen a vertonen hogere oxidatietoestanden gelijk aan het groepsnummer, inclusief Xe; 3) I heeft zwakke metaalachtige eigenschappen. De aard van de verandering in eigenschappen naarmate Z toeneemt voor elementen uit de vierde en vijfde periode is dus complexer, aangezien metaaleigenschappen behouden blijven over een groot bereik van rangtelwoorden.
Zesde periode van het periodiek systeem der elementen
De zesde periode (Cs - Rn) omvat 32 elementen. Naast 10 d-elementen (La, Hf - Hg) bevat het een set van 14 f-elementen, lanthaniden, van Ce tot Lu (zwarte symbolen). De elementen La tot en met Lu lijken chemisch behoorlijk op elkaar. In korte vorm P. s. e. de lanthaniden zijn opgenomen in het La-vak (aangezien hun overheersende oxidatietoestand III is) en worden als een aparte regel onderaan de tabel geschreven. Deze techniek is enigszins lastig, omdat 14 elementen buiten de tabel lijken te liggen. De lange en trapvormige vormen van P. s hebben niet zo'n nadeel. e., wat de specificiteit van lanthaniden goed weerspiegelt tegen de achtergrond van de integrale structuur van de P. s. e. Kenmerken van de periode: 1) in de triade Os - Ir - Pt vertoont alleen osmium oxidatietoestand VIII; 2) At heeft een meer uitgesproken (vergeleken met 1) metaalachtig karakter; 3) Rn zou blijkbaar (de chemie ervan is weinig bestudeerd) het meest reactieve van de inerte gassen moeten zijn.