Apakah yang ditunjukkan oleh nombor tempoh? Kimia dan mendapat jawapan yang terbaik
Jawapan daripada TheLastDreamer[guru]
Tempoh ialah deretan sistem berkala unsur kimia, urutan atom mengikut urutan peningkatan cas nuklear dan mengisi kulit elektron terluar dengan elektron.
Jadual berkala mempunyai tujuh titik. Periode pertama, yang mengandungi 2 unsur, serta yang kedua dan ketiga, yang mengandungi 8 unsur setiap satu, dipanggil kecil. Tempoh yang tinggal dengan 18 atau lebih elemen adalah besar. Tempoh ketujuh tidak selesai. Bilangan tempoh kepunyaan unsur kimia ditentukan oleh bilangan kulit elektronnya (paras tenaga).
Setiap noktah (kecuali yang pertama) bermula dengan logam biasa (Li, Na, K, Rb, Cs, Fr) dan berakhir dengan gas mulia (He, Ne, Ar, Kr, Xe, Rn), yang didahului oleh bukan logam biasa.
Nombor caj nukleus atom (sinonim: nombor atom, nombor atom, nombor ordinal unsur kimia) ialah bilangan proton dalam nukleus atom. Nombor cas adalah sama dengan cas nukleus dalam unit cas asas dan pada masa yang sama sama dengan nombor siri unsur kimia yang sepadan dengan nukleus dalam jadual berkala.
Sekumpulan sistem berkala unsur kimia ialah urutan atom dalam peningkatan cas nuklear yang mempunyai struktur elektronik yang sama.
Nombor kumpulan ditentukan oleh bilangan elektron dalam kulit luar atom (elektron valensi) dan, sebagai peraturan, sepadan dengan valensi tertinggi atom.
Dalam versi jangka pendek sistem berkala, kumpulan dibahagikan kepada subkumpulan - utama (atau subkumpulan A), bermula dengan unsur-unsur tempoh pertama dan kedua, dan sekunder (subkumpulan B), yang mengandungi unsur-d. Subkumpulan juga dinamakan sempena unsur dengan cas nuklear terendah (biasanya unsur tempoh kedua untuk subkumpulan utama dan unsur tempoh keempat untuk subkumpulan sekunder). Unsur-unsur subkumpulan yang sama mempunyai sifat kimia yang serupa.
Dengan peningkatan dalam cas nuklear unsur-unsur kumpulan yang sama, disebabkan oleh peningkatan dalam bilangan kulit elektron, jejari atom meningkat, mengakibatkan penurunan keelektronegatifan, peningkatan dalam logam dan kelemahan sifat bukan logam. unsur, peningkatan dalam mengurangkan dan melemahkan sifat oksidatif bahan yang terbentuk.
TheLastDreamer
Kepintaran yang lebih tinggi
(104014)
Baca di atas.
Jawapan daripada Yoldar Baizhanov[guru]
Ia menunjukkan bilangan elektron dan proton.
Jawapan daripada 2 jawapan[guru]
hello! Berikut ialah pilihan topik dengan jawapan kepada soalan anda: Apakah yang ditunjukkan oleh nombor tempoh? Kimia
Persoalan subjek kimia, seperti mana-mana soalan falsafah, mempunyai retrospektif sejarah.
Tempoh pra-alkimia
Sebagai bidang aktiviti praktikal, kimia mempunyai akar pada zaman purba. Jauh sebelum era kita, manusia telah mengenali perubahan pelbagai bahan dan belajar menggunakannya untuk keperluannya. Asal-usul kimia termasuk doktrin atomistik, yang merupakan alternatif pada masa itu, dan doktrin unsur unsur falsafah semula jadi purba.
Tempoh alkimia
Pada abad ke-3-4 Masihi. e. Alkimia timbul di Alexandria, mengiktiraf kemungkinan mengubah logam asas menjadi yang mulia - emas dan perak - dengan bantuan batu ahli falsafah. Perkara utama dalam pengajaran kimia tempoh ini adalah pemerhatian sifat individu bahan dan penjelasannya dengan bantuan bahan (prinsip) yang kononnya termasuk dalam komposisi bahan ini.
Tempoh penyatuan kimia
Pada abad ke-15 dan ke-16, Eropah memulakan tempoh pertumbuhan pesat dalam perdagangan dan pengeluaran bahan. Menjelang abad ke-16, teknologi di Eropah telah mencapai tahap yang jauh lebih tinggi berbanding semasa zaman kegemilangan Dunia Purba. Pada masa yang sama, perubahan dalam teknik teknikal mendahului pemahaman teori mereka. Peningkatan teknologi selanjutnya terletak pada percanggahan utama era - percanggahan antara tahap pengetahuan teknologi yang agak tinggi yang dicapai pada masa itu dan ketinggalan mendadak dalam sains semula jadi teori.
Pada awal abad ke-17, karya-karya falsafah utama muncul yang mempunyai kesan yang besar terhadap perkembangan sains semula jadi. Ahli falsafah Inggeris Francis Bacon mengemukakan tesis bahawa hujah yang menentukan dalam perbincangan saintifik haruslah eksperimen. Abad ketujuh belas dalam falsafah juga ditandai dengan kebangkitan idea atomistik. Ahli matematik (pengasas geometri analitik) dan ahli falsafah René Descartes berhujah bahawa semua badan terdiri daripada corpuscles pelbagai bentuk dan saiz; bentuk corpuscles adalah berkaitan dengan sifat-sifat bahan. Pada masa yang sama, Descartes percaya bahawa corpuscles boleh dibahagikan dan terdiri daripada satu jirim. Descartes menafikan idea Democritus tentang atom-atom yang tidak boleh dibahagikan yang bergerak dalam kekosongan, tidak berani mengakui kewujudan kekosongan. Idea korpuskular, sangat dekat dengan idea purba Epicurus, juga dinyatakan oleh ahli falsafah Perancis Pierre Gassendi. Gassendi dipanggil kumpulan atom membentuk molekul sebatian (dari lat. tahi lalat- sekumpulan). Konsep korpuskular Gassendi telah mendapat pengiktirafan yang agak luas di kalangan saintis semula jadi.
Pada abad ke-17, sains semula jadi eksperimen baru menjadi alat untuk menyelesaikan percanggahan antara tahap teknologi yang tinggi dan tahap pengetahuan yang sangat rendah tentang alam semula jadi.
Salah satu akibat daripada revolusi saintifik yang berlaku pada separuh kedua abad ke-17 ialah penciptaan kimia saintifik baru. Robert Boyle secara tradisinya dianggap sebagai pencipta kimia saintifik, yang membuktikan ketidakkonsistenan idea alkimia, memberikan definisi saintifik pertama tentang konsep unsur kimia, dan dengan itu buat pertama kalinya meningkatkan kimia ke tahap sains.
Saintis British Robert Boyle adalah salah seorang ahli kimia, ahli fizik dan ahli falsafah terhebat pada zamannya. Pencapaian saintifik utama Boyle dalam kimia termasuk asas kimia analitikal (analisis kualitatif), kajian sifat asid, pengenalan penunjuk ke dalam amalan kimia, dan kajian ketumpatan cecair menggunakan hidrometer yang diciptanya. Adalah mustahil untuk tidak menyebut undang-undang yang ditemui oleh Boyle, yang membawa namanya (juga dipanggil undang-undang Boyle-Mariotte).
Walau bagaimanapun, kelebihan utama Boyle ialah sistem baru falsafah kimia yang dicadangkan, yang digariskan dalam buku "The Skeptical Chemist" (1661). Buku itu dikhaskan untuk mencari jawapan kepada persoalan tentang apa sebenarnya elemen yang harus dipertimbangkan, berdasarkan tahap perkembangan kimia semasa. Boyle menulis:
“Ahli kimia sehingga kini telah dipandu oleh prinsip yang terlalu sempit yang tidak memerlukan ufuk mental yang sangat luas; mereka melihat tugas mereka dalam penyediaan ubat-ubatan, dalam pengeluaran dan transformasi logam. Saya melihat kimia dari sudut pandangan yang sama sekali berbeza: bukan sebagai doktor, bukan sebagai ahli alkimia, tetapi sebagai ahli falsafah harus melihatnya. Saya telah menggariskan di sini rancangan untuk falsafah kimia, yang saya harap dapat dilaksanakan dan diperbaiki dengan eksperimen dan pemerhatian saya.".
Buku ini disusun dalam bentuk perbualan antara empat ahli falsafah: Themist, seorang peripatetik (pengikut Aristotle), Philoponus, seorang spagyricist (penyokong Paracelsus), Carneades, yang menghuraikan pandangan "Mr. Boyle," dan Eleutherius, yang menilai secara saksama hujah-hujah pihak yang bersengketa. Perbincangan ahli falsafah membawa pembaca kepada kesimpulan bahawa baik empat unsur Aristotle, mahupun tiga prinsip ahli alkimia tidak boleh diiktiraf sebagai unsur. Boyle menekankan:
"Tidak ada sebab untuk memberikan kepada badan tertentu nama unsur ini atau itu semata-mata kerana ia menyerupainya dalam satu sifat yang mudah dilihat; lagipun, dengan hak yang sama saya boleh menolaknya nama ini, kerana sifat lain adalah berbeza.".
Berdasarkan data eksperimen, Boyle menunjukkan bahawa konsep kimia moden mesti disemak dan dibawa selaras dengan eksperimen.
Elemen, menurut Boyle, secara praktikalnya adalah jasad (zat) yang tidak boleh terurai, yang terdiri daripada korpuskel homogen (terdiri daripada jirim primer) yang serupa, dari mana semua jasad kompleks tersusun dan ke dalamnya ia boleh diuraikan. Korpuskel boleh berbeza dalam bentuk, saiz, dan jisim. Korpuskel dari mana badan terbentuk kekal tidak berubah semasa transformasi yang terakhir.
Boyle melihat tugas utama kimia dalam kajian komposisi bahan dan pergantungan sifat bahan pada komposisinya. Pada masa yang sama, Boyle menganggap mungkin untuk menggunakan konsep gubahan hanya apabila mungkin untuk memulihkan badan asal daripada unsur-unsur yang diasingkan daripada badan kompleks tertentu (iaitu, dia sebenarnya mengambil sintesis sebagai kriteria untuk ketepatan analisis ). Boyle dalam tulisannya tidak menamakan satu unsur pun dalam pemahaman baru konsep ini; Dia tidak menunjukkan bilangan elemen, hanya menyatakan bahawa:
"Adalah tidak masuk akal untuk menganggap bahawa bilangannya lebih daripada tiga atau empat".
Oleh itu, buku "The Skeptical Chemist" bukanlah jawapan kepada soalan-soalan mendesak tentang falsafah kimia, tetapi penetapan matlamat baru untuk kimia. Kepentingan utama karya Boyle ialah:
1. Perumusan matlamat baru kimia - mengkaji komposisi bahan dan pergantungan sifat bahan pada komposisinya.
2. Cadangan program untuk mencari dan mengkaji unsur kimia sebenar;
3. Pengenalan kepada kimia kaedah induktif;
Idea Boyle tentang unsur itu sebagai bahan yang hampir tidak boleh terurai dengan cepat mendapat penerimaan luas di kalangan saintis semula jadi. Walau bagaimanapun, penciptaan idea teori tentang komposisi badan yang boleh menggantikan ajaran Aristotle dan teori merkuri-sulfur ternyata menjadi tugas yang sangat sukar. Pada suku terakhir abad ke-17, pandangan eklektik muncul, penciptanya cuba menghubungkan tradisi alkimia dan idea baharu tentang unsur kimia. Pandangan ahli kimia Perancis Nicolas Lemery, pengarang buku teks yang terkenal "Kursus Kimia," mempunyai pengaruh yang besar pada sezamannya.
Buku teks Lemery bermula dengan definisi subjek kimia:
"Kimia ialah satu seni yang mengajar cara mengasingkan pelbagai bahan yang terkandung dalam badan bercampur. Saya faham dengan badan bercampur yang terbentuk di alam iaitu: galian, badan tumbuhan dan haiwan".
Seterusnya, Lemery menyenaraikan "prinsip kimia," iaitu komponen utama badan. Selepas "semangat universal" tertentu (yang penulis sendiri akui sebagai "agak metafizik"), Lemery, berdasarkan analisis melalui api, mengenal pasti lima prinsip bahan asas bahan: alkohol (sebaliknya "merkuri"), minyak (sebaliknya "sulfur" ”), garam, air ( "kahak") dan tanah. Tiga prinsip pertama adalah aktif, air dan bumi adalah pasif.
Lemery, bagaimanapun, menyatakan bahawa bahan-bahan ini adalah "permulaan" untuk kita hanya setakat ahli kimia tidak dapat menguraikan lagi badan-badan ini; Jelas sekali, "permulaan" ini boleh dibahagikan kepada yang lebih mudah. Oleh itu, apa yang diterima sebagai prinsip adalah bahan yang diperolehi dengan pengasingan badan campuran dan diasingkan hanya setakat cara yang ada pada pelupusan ahli kimia membenarkan ini dilakukan.
Pada permulaan abad ke-17 dan ke-18, kimia saintifik hanya pada permulaan perjalanannya; Halangan paling penting yang perlu diatasi adalah tradisi alkimia yang masih kuat (Boyle mahupun Lemery tidak menafikan kemungkinan asas transmutasi), idea palsu tentang pembakaran logam sebagai penguraian, dan sifat spekulatif (spekulatif) atomisme.
Falsafah abad ke-18 ialah falsafah fikiran, akal, pemikiran saintifik. Fikiran manusia cuba memahami dunia di sekeliling kita dengan bantuan pengetahuan saintifik, pertimbangan, pemerhatian dan kesimpulan logik, berbanding dengan skolastik zaman pertengahan dan pematuhan buta kepada dogma gereja. Ini juga menjejaskan kimia. Teori pertama kimia saintifik mula muncul.
Teori pertama kimia saintifik - teori phlogiston - sebahagian besarnya berdasarkan idea tradisional tentang komposisi bahan dan unsur sebagai pembawa sifat tertentu. Namun begitu, justru inilah yang menjadi pada abad ke-18 sebagai syarat utama dan penggerak utama untuk pembangunan doktrin unsur-unsur dan menyumbang kepada pembebasan lengkap kimia daripada alkimia. Ia adalah semasa kewujudan hampir abad teori phlogiston bahawa transformasi alkimia kepada kimia, yang dimulakan oleh Boyle, telah selesai.
Teori pembakaran phlogiston dicipta untuk menerangkan proses pembakaran logam, kajian yang merupakan salah satu masalah terpenting dalam kimia pada akhir abad ke-18. Metalurgi pada masa ini berhadapan dengan dua masalah, penyelesaian yang mustahil tanpa penyelidikan saintifik yang serius - kerugian besar dalam peleburan logam dan krisis bahan api yang disebabkan oleh kemusnahan hutan yang hampir lengkap di Eropah.
Asas untuk teori phlogiston adalah idea tradisional pembakaran sebagai penguraian badan. Gambaran fenomenologi logam menembak telah diketahui umum: logam bertukar menjadi skala, jisimnya lebih besar daripada jisim logam asal; Di samping itu, semasa pembakaran, produk gas yang tidak diketahui sifatnya dibebaskan. Matlamat teori kimia ialah penjelasan rasional tentang fenomena ini, yang boleh digunakan untuk menyelesaikan masalah teknikal tertentu. Idea Aristotle mahupun pandangan alkimia mengenai pembakaran tidak memenuhi syarat terakhir.
Pencipta teori phlogiston dianggap sebagai ahli kimia Jerman Johann Joachim Becher dan Georg Ernst Stahl. Becher, dalam bukunya "Underground Physics", menggariskan pandangannya yang sangat eklektik mengenai bahagian konstituen badan. Ini, pada pendapat beliau, adalah tiga jenis bumi: yang pertama adalah boleh melebur dan berbatu (terra lapidea), yang kedua berminyak dan mudah terbakar (terra pinguis) dan yang ketiga adalah tidak menentu (terra fluida s. mercurialis). Kemudahbakaran mayat, menurut Becher, adalah disebabkan oleh kehadiran sesaat, berlemak, tanah dalam komposisinya. Sistem Becher sangat serupa dengan doktrin alkimia bagi tiga prinsip, di mana kemudahbakaran disebabkan oleh kehadiran sulfur; walau bagaimanapun, Becher percaya bahawa sulfur ialah jasad kompleks yang dibentuk oleh asid dan terra pinguis. Malah, teori Becher mewakili salah satu percubaan pertama untuk menawarkan sesuatu yang baru untuk menggantikan doktrin alkimia bagi tiga prinsip. Becher secara tradisinya menjelaskan peningkatan jisim logam semasa penembakan dengan penambahan "bahan berapi." Pandangan Becher ini berfungsi sebagai prasyarat untuk penciptaan teori phlogiston yang dicadangkan oleh Stahl pada tahun 1703, walaupun mereka mempunyai sedikit persamaan dengannya. Walau bagaimanapun, Stahl sendiri sentiasa mendakwa bahawa pengarang teori itu adalah milik Becher.
Intipati teori phlogiston boleh diringkaskan dalam prinsip asas berikut:
1. Terdapat bahan bahan yang terkandung dalam semua badan mudah terbakar - phlogiston (dari bahasa Yunani φλογιστοζ - mudah terbakar).
2. Pembakaran ialah penguraian jasad dengan pembebasan phlogiston, yang tersebar secara tidak berbalik ke udara. Pergerakan phlogiston seperti pusaran yang dilepaskan daripada badan yang terbakar mewakili api yang boleh dilihat. Hanya tumbuhan boleh mengekstrak phlogiston dari udara.
3. Phlogiston sentiasa digabungkan dengan bahan lain dan tidak boleh diasingkan dalam bentuk tulennya; Bahan yang paling kaya dengan phlogiston adalah bahan yang terbakar tanpa meninggalkan residu.
4. Phlogiston mempunyai jisim negatif.
Teori Stahl, seperti semua pendahulunya, juga berdasarkan idea bahawa sifat-sifat bahan ditentukan oleh kehadiran pembawa khas sifat-sifat ini di dalamnya. Kedudukan teori phlogiston tentang jisim negatif phlogiston bertujuan untuk menjelaskan fakta bahawa jisim skala (atau semua hasil pembakaran, termasuk gas) adalah lebih besar daripada jisim logam yang dibakar.
Proses menembak logam dalam kerangka teori phlogiston boleh diwakili oleh persamaan berikut dengan persamaan kimia:
Logam = Skala + Phlogiston
Untuk mendapatkan logam dari skala (atau dari bijih), mengikut teori, anda boleh menggunakan mana-mana badan yang kaya dengan phlogiston (iaitu, terbakar tanpa sisa) - arang atau arang batu, lemak, minyak sayuran, dll.:
Skala + badan kaya Phlogiston = Logam
Perlu ditekankan bahawa eksperimen hanya boleh mengesahkan kesahihan andaian ini; ini adalah hujah yang baik yang memihak kepada teori Stahl. Teori phlogiston akhirnya diperluaskan kepada sebarang proses pembakaran. Identiti phlogiston dalam semua badan mudah terbakar telah dibuktikan oleh Stahl secara eksperimen: arang batu sama-sama mengurangkan asid sulfurik menjadi sulfur dan tanah menjadi logam. Pernafasan dan pengaratan besi, menurut pengikut Stahl, mewakili proses penguraian badan yang mengandungi phlogiston yang sama, tetapi berjalan lebih perlahan daripada pembakaran.
Teori phlogiston memungkinkan, khususnya, untuk memberikan penjelasan yang boleh diterima untuk proses peleburan logam daripada bijih, yang terdiri daripada yang berikut: bijih, yang mengandungi sedikit phlogiston, dipanaskan dengan arang, yang sangat kaya dengan phlogiston; Dalam kes ini, phlogiston melepasi arang batu ke dalam bijih, dan logam yang kaya dengan phlogiston dan abu miskin phlogiston terbentuk.
Perlu diingatkan bahawa dalam kesusasteraan sejarah terdapat perselisihan yang serius dalam menilai peranan teori phlogiston - dari negatif secara mendadak kepada positif. Walau bagaimanapun, tidak dapat dinafikan bahawa teori phlogiston mempunyai beberapa kelebihan yang tidak diragui:
– ia secara ringkas dan mencukupi menerangkan fakta eksperimen mengenai proses pembakaran;
– teori itu konsisten secara dalaman, iaitu. tiada akibat yang bercanggah dengan peruntukan utama;
– teori phlogiston sepenuhnya berdasarkan fakta eksperimen;
– teori phlogiston mempunyai kebolehan meramal.
Teori phlogiston, teori kimia pertama yang benar-benar saintifik, berfungsi sebagai rangsangan yang kuat untuk pembangunan analisis kuantitatif badan kompleks, tanpanya pengesahan percubaan idea tentang unsur kimia akan menjadi sangat mustahil. Perlu diingatkan bahawa pernyataan tentang jisim negatif phlogiston sebenarnya dibuat berdasarkan undang-undang pemuliharaan jisim, yang ditemui lebih lama kemudian. Anggapan ini dengan sendirinya menyumbang kepada penyelidikan kuantitatif yang lebih intensif. Satu lagi hasil penciptaan teori phlogiston ialah kajian aktif oleh ahli kimia gas secara am dan produk pembakaran gas khususnya. Menjelang pertengahan abad ke-18, kimia pneumatik menjadi salah satu cabang kimia yang paling penting, yang pengasasnya Joseph Black, Daniel Rutherford, Henry Cavendish, Joseph Priestley dan Karl Wilhelm Scheele adalah pencipta keseluruhan sistem kaedah kuantitatif dalam kimia.
Pada separuh kedua abad ke-18, teori phlogiston mendapat pengiktirafan yang hampir universal di kalangan ahli kimia. Berdasarkan konsep phlogiston, tatanama bahan telah dibentuk; Percubaan telah dibuat untuk menghubungkan sifat-sifat bahan seperti warna, ketelusan, kealkalian, dsb., dengan kandungan phlogiston di dalamnya. Ahli kimia Perancis Pierre Joseph Maceur, pengarang buku teks yang sangat popular "Unsur Kimia" dan "Kamus Kimia", menulis pada tahun 1778 bahawa teori phlogiston
"... adalah yang paling jelas dan paling konsisten dengan fenomena kimia. Berbeza daripada sistem yang dihasilkan oleh imaginasi tanpa persetujuan dengan alam semula jadi dan dimusnahkan oleh pengalaman, teori Stahl adalah panduan yang paling boleh dipercayai dalam penyelidikan kimia. Banyak eksperimen... bukan sahaja jauh daripada menyangkalnya, tetapi, sebaliknya, menjadi bukti yang memihak kepadanya".
Ironinya, buku teks dan kamus Maceur muncul ketika zaman teori phlogiston semakin hampir ke penghujungnya.
Idea bukan phlogiston tentang pembakaran dan pernafasan malah timbul agak awal daripada teori phlogiston. Jean Rey, kepada siapa sains berhutang postulat "semua badan adalah berat," mencadangkan seawal 1630 bahawa peningkatan jisim logam semasa penembakan adalah disebabkan oleh penambahan udara. Pada tahun 1665, Robert Hooke, dalam karyanya "Micrography," juga mencadangkan kehadiran di udara bahan khas yang serupa dengan bahan yang terkandung dalam keadaan terikat dalam saltpeter.
Pandangan ini dikembangkan lagi dalam buku "On saltpeter and airborne alcohol of saltpeter," yang ditulis pada tahun 1669 oleh ahli kimia Inggeris John Mayow. Mayow cuba membuktikan bahawa udara mengandungi gas khas (spiritus nitroaëreus) yang menyokong pembakaran dan diperlukan untuk pernafasan; Dia mengesahkan andaian ini dengan eksperimen terkenal dengan lilin yang menyala di bawah loceng. Walau bagaimanapun, adalah mungkin untuk mengasingkan spiritus nitroaëreus ini dalam keadaan bebas hanya selepas lebih daripada seratus tahun. Penemuan oksigen dibuat secara bebas antara satu sama lain hampir serentak oleh beberapa saintis.
Karl Wilhelm Scheele memperoleh oksigen pada tahun 1771, memanggilnya "udara berapi"; bagaimanapun, hasil eksperimen Scheele hanya diterbitkan pada tahun 1777. Menurut Scheele, "udara berapi" ialah "bahan nipis berasid yang digabungkan dengan phlogiston."
Joseph Priestley mengasingkan oksigen pada tahun 1774 dengan memanaskan merkuri oksida. Priestley percaya bahawa gas yang diperolehnya adalah udara tanpa phlogiston sepenuhnya, akibatnya pembakaran berjalan lebih baik dalam "udara dephlogisticated" ini daripada udara biasa.
Di samping itu, penemuan hidrogen oleh Cavendish pada tahun 1766 dan nitrogen oleh Rutherford pada tahun 1772 (perlu diingatkan bahawa Cavendish mengira hidrogen sebagai phlogiston tulen) adalah sangat penting untuk penciptaan teori oksigen pembakaran.
Kepentingan penemuan yang dibuat oleh Scheele dan Priestley dapat dinilai dengan betul oleh ahli kimia Perancis Antoine Laurent Lavoisier. Pada tahun 1774, Lavoisier menerbitkan risalah "Kerja Kecil tentang Fizik dan Kimia," di mana beliau mencadangkan bahawa semasa pembakaran, sebahagian daripada udara atmosfera ditambahkan ke badan. Selepas Priestley melawat Paris pada tahun 1774 dan memberitahu Lavoisier tentang penemuan "udara dephlogisticated," Lavoisier mengulangi eksperimennya dan pada tahun 1775 menerbitkan karya "Tentang sifat bahan yang bergabung dengan logam apabila dikalsinasi dan meningkatkan beratnya" (bagaimanapun, Lavoisier). mengaitkan keutamaan penemuan oksigen kepada dirinya sendiri). Akhirnya, pada tahun 1777, Lavoisier merumuskan prinsip utama teori pembakaran oksigen:
1. Badan terbakar hanya dalam "udara bersih".
2. "Udara bersih" diserap semasa pembakaran, dan peningkatan jisim badan yang terbakar adalah sama dengan penurunan jisim udara.
3. Apabila dipanaskan, logam bertukar menjadi "bumi". Sulfur atau fosforus, digabungkan dengan "udara bersih", bertukar menjadi asid.
Teori pembakaran oksigen baharu (istilah oksigen – oxygenium – muncul pada tahun 1877 dalam karya Lavoisier “Pertimbangan umum sifat asid dan prinsip gabungannya”) mempunyai beberapa kelebihan ketara berbanding teori phlogistik. Ia lebih mudah daripada phlogiston, tidak mengandungi andaian "tidak semulajadi" tentang kehadiran jisim negatif dalam badan, dan, yang paling penting, tidak berdasarkan kewujudan bahan yang tidak diasingkan secara eksperimen. Akibatnya, teori oksigen pembakaran dengan cepat mendapat penerimaan luas di kalangan saintis semula jadi (walaupun kontroversi antara Lavoisier dan phlogistics berterusan selama bertahun-tahun).
Pada penghujung abad ke-18 dan permulaan abad ke-19, sebuah gerakan yang dipanggil Saintisme (daripada sains) bermaharajalela dalam falsafah, yang menampakkan dirinya dalam kekaguman terhadap sains, pemujaan sains dan pengetahuan manusia. Seseorang berbangga dengan pengetahuan dan kecerdasannya, kebebasan, dan yakin dengan keupayaannya untuk menyelesaikan semua masalah yang timbul. Akademi menjadi pusat utama aktiviti saintifik. Pada masa ini, revolusi sedang berlaku dalam sains kimia.
Kepentingan teori oksigen ternyata jauh lebih besar daripada sekadar penjelasan tentang fenomena pembakaran dan pernafasan. Penolakan teori phlogiston memerlukan semakan semula semua prinsip dan konsep asas kimia, perubahan dalam istilah dan tatanama bahan. Oleh itu, dengan penciptaan teori oksigen, titik perubahan dalam pembangunan kimia bermula, yang dipanggil "revolusi kimia".
Pada tahun 1785-1787 Empat ahli kimia Perancis yang cemerlang - Antoine Laurent Lavoisier, Claude Louis Berthollet, Louis Bernard Guiton de Morveau dan Antoine Francois de Fourcroy - bagi pihak Akademi Sains Paris, membangunkan sistem tatanama kimia yang baharu. Logik tatanama baru melibatkan pembinaan nama bahan berdasarkan nama unsur yang mengandungi bahan tersebut. Prinsip asas tatanama ini masih digunakan sehingga kini.
Tempoh ialah deretan sistem berkala unsur kimia, urutan atom mengikut urutan peningkatan cas nuklear dan mengisi kulit elektron terluar dengan elektron.
Jadual berkala mempunyai tujuh titik. Periode pertama, yang mengandungi 2 unsur, serta yang kedua dan ketiga, yang mengandungi 8 unsur setiap satu, dipanggil kecil. Tempoh yang tinggal dengan 18 atau lebih elemen adalah besar. Tempoh ketujuh tidak selesai. Bilangan tempoh kepunyaan unsur kimia ditentukan oleh bilangan kulit elektronnya.
Setiap tempoh bermula dengan logam biasa dan berakhir dengan gas mulia, didahului oleh bukan logam biasa.
Dalam tempoh pertama, selain helium, terdapat hanya satu unsur - hidrogen, yang menggabungkan sifat khas kedua-dua logam dan bukan logam. Subkulit 1s unsur-unsur ini diisi dengan elektron.
Untuk unsur kala kedua dan ketiga, subkulit s dan p diisi secara berurutan. Unsur-unsur jangka pendek dicirikan oleh peningkatan yang agak pesat dalam keelektronegatifan dengan peningkatan cas nuklear, kelemahan sifat logam dan peningkatan dalam bukan logam.
Tempoh keempat dan kelima mengandungi beberapa dekad peralihan unsur-d, di mana, selepas mengisi subkulit-s luar dengan elektron, subkulit-d tahap tenaga sebelumnya diisi, mengikut peraturan Klechkovsky.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 6f 7d 7f ...
Dalam tempoh keenam dan ketujuh, subkulit 4f dan 5f menjadi tepu, akibatnya ia mengandungi 14 lebih elemen berbanding dengan tempoh ke-4 dan ke-5.
Disebabkan oleh perbezaan tempoh dalam panjang dan ciri-ciri lain, terdapat cara yang berbeza bagi susunan relatifnya dalam sistem berkala. Dalam versi jangka pendek, tempoh pendek mengandungi satu baris elemen, noktah besar mempunyai dua baris. Dalam versi tempoh panjang, semua tempoh terdiri daripada satu siri. Siri lantanida dan aktinida biasanya ditulis secara berasingan di bahagian bawah jadual.
Unsur-unsur dalam tempoh yang sama mempunyai jisim atom yang sama, tetapi sifat fizikal dan kimia yang berbeza, tidak seperti unsur-unsur kumpulan yang sama. Dengan peningkatan cas nuklear unsur-unsur dalam tempoh yang sama, jejari atom berkurangan dan bilangan elektron valens meningkat, akibatnya sifat logam dan bukan logam unsur menjadi lemah, sifat pengurangan menjadi lemah dan sifat oksidatif bahan yang dibentuknya diperkukuh.
Jika anda mendapati jadual berkala sukar difahami, anda tidak bersendirian! Walaupun sukar untuk memahami prinsipnya, mempelajari cara menggunakannya akan membantu anda semasa mempelajari sains. Mula-mula, kaji struktur jadual dan maklumat yang boleh anda pelajari daripadanya tentang setiap unsur kimia. Kemudian anda boleh mula mengkaji sifat setiap elemen. Dan akhirnya, menggunakan jadual berkala, anda boleh menentukan bilangan neutron dalam atom unsur kimia tertentu.
Langkah-langkah
Bahagian 1
Struktur jadual-
Seperti yang anda boleh lihat, setiap unsur berikutnya mengandungi satu lagi proton daripada unsur yang mendahuluinya. Ini jelas apabila anda melihat nombor atom. Nombor atom bertambah satu apabila anda bergerak dari kiri ke kanan. Oleh kerana elemen disusun dalam kumpulan, beberapa sel jadual dibiarkan kosong.
- Sebagai contoh, baris pertama jadual mengandungi hidrogen, yang mempunyai nombor atom 1, dan helium, yang mempunyai nombor atom 2. Walau bagaimanapun, ia terletak di hujung yang bertentangan kerana ia tergolong dalam kumpulan yang berbeza.
-
Ketahui tentang kumpulan yang mengandungi unsur dengan sifat fizikal dan kimia yang serupa. Elemen setiap kumpulan terletak dalam lajur menegak yang sepadan. Mereka biasanya dikenal pasti dengan warna yang sama, yang membantu mengenal pasti unsur-unsur dengan sifat fizikal dan kimia yang serupa dan meramalkan tingkah laku mereka. Semua unsur kumpulan tertentu mempunyai bilangan elektron yang sama dalam kulit terluarnya.
- Hidrogen boleh dikelaskan sebagai logam alkali dan halogen. Dalam beberapa jadual ia ditunjukkan dalam kedua-dua kumpulan.
- Dalam kebanyakan kes, kumpulan diberi nombor dari 1 hingga 18, dan nombor diletakkan di bahagian atas atau bawah jadual. Nombor boleh dinyatakan dalam angka Rom (cth IA) atau Arab (cth 1A atau 1).
- Apabila bergerak di sepanjang lajur dari atas ke bawah, anda dikatakan "menyemak imbas kumpulan".
-
Ketahui mengapa terdapat sel kosong dalam jadual. Unsur disusun bukan sahaja mengikut nombor atomnya, tetapi juga mengikut kumpulan (unsur dalam kumpulan yang sama mempunyai sifat fizikal dan kimia yang serupa). Terima kasih kepada ini, lebih mudah untuk memahami bagaimana elemen tertentu berkelakuan. Walau bagaimanapun, apabila nombor atom bertambah, unsur-unsur yang jatuh ke dalam kumpulan yang sepadan tidak selalu dijumpai, jadi terdapat sel kosong dalam jadual.
- Sebagai contoh, 3 baris pertama mempunyai sel kosong kerana logam peralihan hanya ditemui daripada nombor atom 21.
- Unsur dengan nombor atom 57 hingga 102 dikelaskan sebagai unsur nadir bumi, dan biasanya diletakkan dalam subkumpulannya sendiri di sudut kanan bawah jadual.
-
Setiap baris jadual mewakili noktah. Semua unsur dalam tempoh yang sama mempunyai bilangan orbital atom yang sama di mana elektron dalam atom terletak. Bilangan orbital sepadan dengan nombor tempoh. Jadual mengandungi 7 baris, iaitu 7 noktah.
- Contohnya, atom unsur periode pertama mempunyai satu orbital, dan atom unsur periode ketujuh mempunyai 7 orbital.
- Sebagai peraturan, noktah ditetapkan dengan nombor dari 1 hingga 7 di sebelah kiri jadual.
- Semasa anda bergerak mengikut garisan dari kiri ke kanan, anda dikatakan "mengimbas tempoh".
-
Belajar membezakan antara logam, metaloid dan bukan logam. Anda akan lebih memahami sifat sesuatu elemen jika anda boleh menentukan jenis elemen itu. Untuk kemudahan, dalam kebanyakan jadual logam, metaloid dan bukan logam ditetapkan dengan warna yang berbeza. Logam berada di sebelah kiri dan bukan logam berada di sebelah kanan meja. Metaloid terletak di antara mereka.
Bahagian 2
Penamaan unsur-
Setiap elemen ditetapkan oleh satu atau dua huruf Latin. Sebagai peraturan, simbol elemen ditunjukkan dalam huruf besar di tengah-tengah sel yang sepadan. Simbol ialah nama yang dipendekkan untuk unsur yang sama dalam kebanyakan bahasa. Simbol elemen biasanya digunakan semasa menjalankan eksperimen dan bekerja dengan persamaan kimia, jadi adalah berguna untuk mengingatinya.
- Lazimnya, simbol unsur ialah singkatan nama Latinnya, walaupun bagi sesetengah orang, terutamanya unsur yang ditemui baru-baru ini, ia berasal daripada nama biasa. Sebagai contoh, helium diwakili oleh simbol He, yang hampir dengan nama biasa dalam kebanyakan bahasa. Pada masa yang sama, besi ditetapkan sebagai Fe, yang merupakan singkatan dari nama Latinnya.
-
Beri perhatian kepada nama penuh elemen jika ia diberikan dalam jadual. Elemen "nama" ini digunakan dalam teks biasa. Contohnya, "helium" dan "karbon" ialah nama unsur. Biasanya, walaupun tidak selalu, nama penuh unsur disenaraikan di bawah simbol kimianya.
- Kadangkala jadual tidak menunjukkan nama unsur dan hanya memberikan simbol kimianya.
-
Cari nombor atom. Biasanya, nombor atom unsur terletak di bahagian atas sel yang sepadan, di tengah atau di sudut. Ia juga mungkin muncul di bawah simbol atau nama elemen. Unsur mempunyai nombor atom dari 1 hingga 118.
- Nombor atom sentiasa integer.
-
Ingat bahawa nombor atom sepadan dengan bilangan proton dalam atom. Semua atom unsur mengandungi bilangan proton yang sama. Tidak seperti elektron, bilangan proton dalam atom unsur kekal malar. Jika tidak, anda akan mendapat unsur kimia yang berbeza!
- Nombor atom unsur juga boleh menentukan bilangan elektron dan neutron dalam atom.
-
Biasanya bilangan elektron adalah sama dengan bilangan proton. Pengecualian adalah kes apabila atom terion. Proton mempunyai cas positif dan elektron mempunyai cas negatif. Kerana atom biasanya neutral, ia mengandungi bilangan elektron dan proton yang sama. Walau bagaimanapun, atom boleh mendapat atau kehilangan elektron, dalam hal ini ia menjadi terion.
- Ion mempunyai cas elektrik. Jika ion mempunyai lebih banyak proton, ia mempunyai cas positif, di mana tanda tambah diletakkan selepas simbol unsur. Jika ion mengandungi lebih banyak elektron, ia mempunyai cas negatif, yang ditunjukkan oleh tanda tolak.
- Tanda tambah dan tolak tidak digunakan jika atom bukan ion.
-
Jadual berkala, atau jadual berkala unsur kimia, bermula di sudut kiri atas dan berakhir pada penghujung baris terakhir jadual (sudut kanan bawah). Unsur-unsur dalam jadual disusun dari kiri ke kanan mengikut peningkatan tertib nombor atomnya. Nombor atom menunjukkan bilangan proton yang terkandung dalam satu atom. Selain itu, apabila nombor atom bertambah, jisim atom juga bertambah. Oleh itu, dengan lokasi unsur dalam jadual berkala, jisim atomnya boleh ditentukan.
Tempoh ialah deretan sistem berkala unsur kimia, urutan atom mengikut urutan peningkatan cas nuklear dan mengisi kulit elektron terluar dengan elektron.
Jadual berkala mempunyai tujuh titik. Periode pertama, yang mengandungi 2 unsur, serta yang kedua dan ketiga, yang mengandungi 8 unsur setiap satu, dipanggil kecil. Tempoh yang tinggal dengan 18 atau lebih elemen adalah besar. Tempoh ketujuh tidak selesai. Bilangan tempoh kepunyaan unsur kimia ditentukan oleh bilangan kulit elektronnya (paras tenaga).
Nombor caj nukleus atom (sinonim: nombor atom, nombor atom, nombor ordinal unsur kimia) ialah bilangan proton dalam nukleus atom. Nombor cas adalah sama dengan cas nukleus dalam unit cas asas dan pada masa yang sama sama dengan nombor siri unsur kimia yang sepadan dengan nukleus dalam jadual berkala.
Sekumpulan sistem berkala unsur kimia ialah urutan atom dalam peningkatan cas nuklear yang mempunyai struktur elektronik yang sama.
Dalam versi jangka pendek sistem berkala, kumpulan dibahagikan kepada subkumpulan - utama (atau subkumpulan A), bermula dengan unsur-unsur tempoh pertama dan kedua, dan sekunder (subkumpulan B), yang mengandungi unsur-d. Subkumpulan juga dinamakan sempena unsur dengan cas nuklear terendah (biasanya unsur tempoh kedua untuk subkumpulan utama dan unsur tempoh keempat untuk subkumpulan sekunder). Unsur-unsur subkumpulan yang sama mempunyai sifat kimia yang serupa.
apakah tempoh dalam kimia
- Tempoh ialah deretan sistem berkala unsur kimia, urutan atom mengikut urutan peningkatan cas nuklear dan mengisi kulit elektron terluar dengan elektron.
Jadual berkala mempunyai tujuh titik. Periode pertama, yang mengandungi 2 unsur, serta yang kedua dan ketiga, yang mengandungi 8 unsur setiap satu, dipanggil kecil. Tempoh selebihnya yang mempunyai 18 atau lebih elemen adalah besar. Tempoh ketujuh tidak selesai. Bilangan tempoh kepunyaan unsur kimia ditentukan oleh bilangan kulit elektronnya (paras tenaga).
Setiap noktah (kecuali yang pertama) bermula dengan logam biasa (Li, Na, K, Rb, Cs, Fr) dan berakhir dengan gas mulia (He, Ne, Ar, Kr, Xe, Rn), yang didahului oleh bukan logam biasa.
Subuh#769;tarikh#769; nukleus atom (sinonim: nombor atom, nombor atom, nombor atom unsur kimia) bilangan proton dalam nukleus atom. Nombor cas adalah sama dengan cas nukleus dalam unit cas asas dan pada masa yang sama sama dengan nombor siri unsur kimia yang sepadan dengan nukleus dalam jadual berkala.
Sekumpulan sistem berkala unsur kimia ialah urutan atom dalam peningkatan cas nuklear yang mempunyai struktur elektronik yang sama.
Nombor kumpulan ditentukan oleh bilangan elektron dalam kulit luar atom (elektron valensi) dan, sebagai peraturan, sepadan dengan valensi tertinggi atom.
Dalam versi jangka pendek sistem berkala, kumpulan dibahagikan kepada subkumpulan utama (atau subkumpulan A), bermula dengan unsur-unsur tempoh pertama dan kedua, dan sekunder (subkumpulan B), yang mengandungi unsur-d. Subkumpulan juga dinamakan sempena unsur yang mempunyai cas nuklear paling rendah (biasanya unsur zaman kedua untuk subkumpulan utama dan unsur tempoh keempat untuk subkumpulan subsidiari). Unsur-unsur subkumpulan yang sama mempunyai sifat kimia yang serupa.
Dengan peningkatan dalam cas nuklear unsur-unsur kumpulan yang sama, disebabkan oleh peningkatan dalam bilangan kulit elektron, jejari atom meningkat, mengakibatkan penurunan keelektronegatifan, peningkatan dalam logam dan kelemahan sifat bukan logam. unsur, peningkatan dalam mengurangkan dan melemahkan sifat oksidatif bahan yang terbentuk.
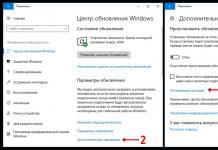
- Baris mendatar dalam jadual. Mendeleev
- Jadual garisan mendatar (ta sho zleva). Mendelev
Evolusi jadual berkala unsur kimia
Idea yang diperkenalkan oleh Mendeleev tentang tempat sesuatu unsur dalam sistem ternyata istimewa dan penting untuk evolusi sistem berkala unsur kimia; Kedudukan unsur ditentukan oleh tempoh dan nombor kumpulan. Berdasarkan idea ini, Mendeleev membuat kesimpulan bahawa adalah perlu untuk menukar berat atom yang diterima ketika itu bagi beberapa unsur (U, In, Ce dan analognya), yang merupakan aplikasi praktikal pertama berat atom. e., dan juga untuk pertama kalinya meramalkan kewujudan dan sifat asas beberapa unsur yang tidak diketahui, yang sepadan dengan sel kosong P. s. e. Contoh klasik ialah ramalan "ekaaluminum" (Ga akan datang, ditemui oleh P. Lecoq de Boisbaudran pada tahun 1875), "ecaboron" (Sc, ditemui oleh saintis Sweden L. Nilsson pada tahun 1879) dan "ekasilikon" (Ge, ditemui oleh saintis Jerman K. Winkler pada tahun 1886). Di samping itu, Mendeleev meramalkan kewujudan analog mangan (masa depan Tc dan Re), telurium (Po), iodin (At), cesium (Fr), barium (Ra), tantalum (Pa).
Dalam banyak cara, ia mewakili generalisasi fakta empirikal, kerana makna fizikal undang-undang berkala tidak jelas dan tidak ada penjelasan tentang sebab-sebab perubahan berkala dalam sifat unsur bergantung kepada pertambahan berat atom.
ini pergi sepanjang jalan kepada pengesahan fizikal undang-undang berkala dan perkembangan teori P. s. e. banyak fakta yang tidak dapat dijelaskan. Oleh itu, penemuan pada akhir abad ke-19 adalah di luar jangkaan. gas lengai, yang seolah-olah tidak mempunyai tempat di P. s. e.; kesukaran ini telah dihapuskan berkat kemasukan p. e. kumpulan sifar bebas (kemudian VIIIa-subkumpulan). Penemuan banyak "elemen radio" pada awal abad ke-20. membawa kepada percanggahan antara keperluan untuk penempatan mereka di P. s. e. dan strukturnya (untuk lebih daripada 30 elemen sedemikian terdapat 7 tempat "kosong" dalam tempoh keenam dan ketujuh). Percanggahan ini dapat diatasi hasil daripada penemuan isotop. Akhirnya, nilai berat atom (jisim atom) sebagai parameter yang menentukan sifat unsur secara beransur-ansur kehilangan kepentingannya.
Struktur jadual berkala unsur kimia.
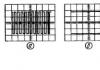
Moden (1975) P. hlm. e. meliputi 106 unsur kimia; daripada ini, semua transuranium (Z = 93-106), serta unsur dengan Z = 43 (Tc), 61 (Pm), 85 (At) dan 87 (Fr) diperoleh secara buatan. Sepanjang sejarah P. s. e. sebilangan besar (beberapa ratus) pilihan untuk perwakilan grafiknya dicadangkan, terutamanya dalam bentuk jadual; Imej juga dikenali dalam bentuk pelbagai angka geometri (spatial dan planar), lengkung analitikal (contohnya, lingkaran), dsb. Tiga bentuk P. paling meluas.
e.: pendek, dicadangkan oleh Mendeleev (Rajah 2) dan menerima pengiktirafan sejagat (dalam bentuk modennya diberikan dalam ilustrasi); panjang (Rajah 3); tangga (Gamb. 4). Bentuk panjang juga dibangunkan oleh Mendeleev, dan dalam bentuk yang lebih baik ia dicadangkan pada tahun 1905 oleh A. Werner. Bentuk tangga telah dicadangkan oleh saintis Inggeris T. Bailey (1882), saintis Denmark J. Thomsen (1895) dan diperbaiki oleh N. Bohr (1921). Setiap tiga bentuk mempunyai kelebihan dan kekurangan. Prinsip asas membina P. s. e. ialah pembahagian semua unsur kimia kepada kumpulan dan tempoh. Setiap kumpulan dibahagikan kepada subkumpulan utama (a) dan sekunder (b). Setiap subkumpulan mengandungi unsur-unsur yang mempunyai sifat kimia yang serupa. Unsur-unsur subkumpulan a- dan b dalam setiap kumpulan, sebagai peraturan, mempamerkan persamaan kimia tertentu antara satu sama lain, terutamanya dalam keadaan pengoksidaan yang lebih tinggi, yang, sebagai peraturan, sepadan dengan nombor kumpulan. Tempoh ialah himpunan unsur yang bermula dengan logam alkali dan berakhir dengan gas lengai (kes khas ialah tempoh pertama); Setiap tempoh mengandungi bilangan elemen yang ditetapkan dengan ketat. P.S. e. terdiri daripada 8 kumpulan dan 7 tempoh (yang ketujuh masih belum selesai).
Tempoh pertama jadual berkala unsur
Kekhususan tempoh pertama ialah ia mengandungi hanya 2 unsur: H dan He. Tempat H dalam sistem adalah samar-samar: hidrogen mempamerkan sifat biasa kepada logam alkali dan halogen; ia diletakkan sama ada dalam Ia-atau (sebaik-baiknya) dalam subkumpulan VIIa. Helium ialah wakil pertama subkumpulan VIIa (namun, untuk masa yang lama He dan semua gas lengai digabungkan menjadi kumpulan sifar bebas).
Tempoh kedua jadual berkala unsur
Kala kedua (Li - Ne) mengandungi 8 unsur. Ia bermula dengan logam alkali Li, satu-satunya keadaan pengoksidaan yang mana ialah I. Kemudian datang Be, logam, keadaan pengoksidaan II. Sifat logam unsur B seterusnya dinyatakan dengan lemah (keadaan pengoksidaan III). C berikut ialah bukan logam biasa dan boleh sama ada tetravalen positif atau negatif. N, O, F dan Ne berikut adalah bukan logam, dan hanya untuk N keadaan pengoksidaan tertinggi V sepadan dengan nombor kumpulan; oksigen hanya jarang menunjukkan valensi positif, dan untuk F keadaan pengoksidaan VI diketahui. Tempoh itu berakhir dengan gas lengai Ne.
Tempoh ketiga jadual berkala unsur
Tempoh ketiga (Na - Ar) juga mengandungi 8 unsur, sifat perubahan sifat yang sebahagian besarnya serupa dengan yang diperhatikan dalam tempoh kedua. Walau bagaimanapun, Mg, tidak seperti Be, adalah lebih logam, seperti Al berbanding B, walaupun Al secara semula jadi amfoterik. Si, P, S, Cl, Ar ialah bukan logam biasa, tetapi kesemuanya (kecuali Ar) mempamerkan keadaan pengoksidaan yang lebih tinggi bersamaan dengan nombor kumpulan. Oleh itu, dalam kedua-dua tempoh, apabila Z meningkat, kelemahan logam dan pengukuhan sifat bukan logam unsur diperhatikan. Mendeleev memanggil unsur-unsur tempoh kedua dan ketiga (kecil, dalam istilahnya) tipikal. Adalah penting bahawa ia adalah antara yang paling biasa dalam alam semula jadi, dan C, N dan O adalah, bersama-sama dengan H, unsur utama bahan organik (organogen). Semua elemen tiga tempoh pertama termasuk dalam subkumpulan a.
Terminologi moden - unsur-unsur zaman ini merujuk kepada unsur-s (logam alkali dan alkali tanah), komponen subkumpulan Ia- dan IIa (diserlahkan dengan warna merah pada jadual warna), dan unsur-p (B - Ne, At - Ar), termasuk dalam subkumpulan IIIa - VIIIa (simbol mereka diserlahkan dalam oren). Untuk unsur-unsur tempoh kecil, dengan peningkatan nombor atom, pengurangan dalam jejari atom mula-mula diperhatikan, dan kemudian, apabila bilangan elektron dalam kulit luar atom sudah meningkat dengan ketara, tolakan bersama mereka membawa kepada peningkatan dalam jejari atom. Maksimum seterusnya dicapai pada permulaan tempoh seterusnya pada unsur alkali. Kira-kira corak yang sama adalah ciri jejari ionik.
Tempoh keempat jadual berkala unsur
Tempoh keempat (K - Kr) mengandungi 18 elemen (tempoh utama pertama, menurut Mendeleev). Selepas logam alkali K dan alkali tanah Ca (s-elemen), terdapat sepuluh siri yang dipanggil unsur peralihan (Sc - Zn), atau d-elemen (simbol ditunjukkan dalam warna biru), yang termasuk dalam subkumpulan. b daripada kumpulan P. s yang sepadan. e. Kebanyakan unsur peralihan (semuanya adalah logam) mempamerkan keadaan pengoksidaan yang lebih tinggi sama dengan nombor kumpulannya. Pengecualian ialah triad Fe - Co - Ni, di mana dua unsur terakhir adalah trivalen positif secara maksimum, dan besi dalam keadaan tertentu diketahui dalam keadaan pengoksidaan VI. Unsur-unsur, bermula dengan Ga dan berakhir dengan Kr (elemen-p), tergolong dalam subkumpulan a, dan sifat perubahan sifatnya adalah sama seperti dalam selang Z yang sepadan untuk unsur-unsur kala kedua dan ketiga. Telah ditetapkan bahawa Kr mampu membentuk sebatian kimia (terutamanya dengan F), tetapi keadaan pengoksidaannya VIII tidak diketahui.
Tempoh kelima jadual berkala unsur
Tempoh kelima (Rb - Xe) dibina sama dengan tempoh keempat; ia juga mempunyai sisipan 10 elemen peralihan (Y - Cd), unsur-d. Ciri khusus tempoh: 1) dalam triad Ru - Rh - Pd, hanya rutenium mempamerkan keadaan pengoksidaan VIII; 2) semua unsur subkumpulan a mempamerkan keadaan pengoksidaan yang lebih tinggi sama dengan nombor kumpulan, termasuk Xe; 3) Saya mempunyai sifat logam yang lemah. Oleh itu, sifat perubahan sifat apabila Z meningkat bagi unsur-unsur kala keempat dan kelima adalah lebih kompleks, kerana sifat logam dikekalkan dalam julat besar nombor ordinal.
Tempoh keenam jadual berkala unsur
Tempoh keenam (Cs - Rn) merangkumi 32 elemen. Sebagai tambahan kepada 10 d-elemen (La, Hf - Hg), ia mengandungi set 14 f-elemen, lantanida, dari Ce hingga Lu (simbol hitam). Unsur La melalui Lu secara kimia agak serupa. Dalam bentuk ringkas P. s. e. lantanida dimasukkan ke dalam kotak La (kerana keadaan pengoksidaan utamanya ialah III) dan ditulis sebagai garis berasingan di bahagian bawah jadual. Teknik ini agak menyusahkan, kerana 14 elemen kelihatan berada di luar jadual. Bentuk panjang dan tangga P. s. tidak mempunyai kelemahan sedemikian. e., mencerminkan kekhususan lantanida dengan latar belakang struktur integral P. s. e. Ciri-ciri tempoh: 1) dalam triad Os - Ir - Pt, hanya osmium mempamerkan keadaan pengoksidaan VIII; 2) At mempunyai ciri logam yang lebih ketara (berbanding 1); 3) Rn, nampaknya (kimianya tidak banyak dikaji), sepatutnya menjadi gas lengai yang paling reaktif.