പിരീഡ് നമ്പർ എന്താണ് സൂചിപ്പിക്കുന്നത്? രസതന്ത്രത്തിനും മികച്ച ഉത്തരം ലഭിച്ചു
TheLastDreamer[guru] ൽ നിന്നുള്ള ഉത്തരം
ഒരു കാലഘട്ടം എന്നത് രാസ മൂലകങ്ങളുടെ ആനുകാലിക വ്യവസ്ഥയുടെ ഒരു നിരയാണ്, ന്യൂക്ലിയർ ചാർജ് വർദ്ധിപ്പിക്കുന്നതിനും പുറം ഇലക്ട്രോൺ ഷെല്ലിൽ ഇലക്ട്രോണുകൾ നിറയ്ക്കുന്നതിനുമുള്ള ആറ്റങ്ങളുടെ ഒരു ശ്രേണി.
ആവർത്തനപ്പട്ടികയിൽ ഏഴ് കാലഘട്ടങ്ങളുണ്ട്. 2 മൂലകങ്ങൾ അടങ്ങുന്ന ആദ്യ കാലഘട്ടം, അതുപോലെ തന്നെ 8 മൂലകങ്ങൾ വീതമുള്ള രണ്ടാമത്തെയും മൂന്നാമത്തേയും ചെറുത് എന്ന് വിളിക്കുന്നു. 18 അല്ലെങ്കിൽ അതിലധികമോ മൂലകങ്ങളുള്ള ശേഷിക്കുന്ന കാലഘട്ടങ്ങൾ വലുതാണ്. ഏഴാമത്തെ പിരീഡ് പൂർത്തിയായിട്ടില്ല. ഒരു രാസ മൂലകം ഉൾപ്പെടുന്ന കാലഘട്ടത്തിൻ്റെ എണ്ണം നിർണ്ണയിക്കുന്നത് അതിൻ്റെ ഇലക്ട്രോൺ ഷെല്ലുകളുടെ (ഊർജ്ജ നിലകൾ) അടിസ്ഥാനത്തിലാണ്.
ഓരോ കാലഘട്ടവും (ആദ്യത്തേത് ഒഴികെ) ഒരു സാധാരണ ലോഹത്തിൽ (Li, Na, K, Rb, Cs, Fr) ആരംഭിച്ച് ഒരു നോബിൾ വാതകത്തിൽ (He, Ne, Ar, Kr, Xe, Rn) അവസാനിക്കുന്നു. ഒരു സാധാരണ നോൺ-മെറ്റൽ.
ആറ്റോമിക് ന്യൂക്ലിയസിൻ്റെ ചാർജ് നമ്പർ (പര്യായങ്ങൾ: ആറ്റോമിക് നമ്പർ, ആറ്റോമിക് നമ്പർ, ഒരു രാസ മൂലകത്തിൻ്റെ ഓർഡിനൽ നമ്പർ) ആറ്റോമിക് ന്യൂക്ലിയസിലെ പ്രോട്ടോണുകളുടെ എണ്ണമാണ്. ചാർജ് നമ്പർ പ്രാഥമിക ചാർജിൻ്റെ യൂണിറ്റുകളിലെ ന്യൂക്ലിയസിൻ്റെ ചാർജിന് തുല്യമാണ്, അതേ സമയം ആവർത്തനപ്പട്ടികയിലെ ന്യൂക്ലിയസുമായി ബന്ധപ്പെട്ട രാസ മൂലകത്തിൻ്റെ സീരിയൽ നമ്പറിന് തുല്യമാണ്.
ഒരേ ഇലക്ട്രോണിക് ഘടനയുള്ള ന്യൂക്ലിയർ ചാർജ് വർദ്ധിപ്പിക്കുന്ന ആറ്റങ്ങളുടെ ഒരു ശ്രേണിയാണ് രാസ മൂലകങ്ങളുടെ ആവർത്തന വ്യവസ്ഥയുടെ ഒരു കൂട്ടം.
ആറ്റത്തിൻ്റെ പുറം ഷെല്ലിലെ ഇലക്ട്രോണുകളുടെ എണ്ണം (വാലൻസ് ഇലക്ട്രോണുകൾ) അനുസരിച്ചാണ് ഗ്രൂപ്പ് നമ്പർ നിർണ്ണയിക്കുന്നത്, ചട്ടം പോലെ, ആറ്റത്തിൻ്റെ ഉയർന്ന വാലൻസിയുമായി യോജിക്കുന്നു.
പീരിയോഡിക് സിസ്റ്റത്തിൻ്റെ ഹ്രസ്വകാല പതിപ്പിൽ, ഗ്രൂപ്പുകളെ ഉപഗ്രൂപ്പുകളായി തിരിച്ചിരിക്കുന്നു - പ്രധാന (അല്ലെങ്കിൽ ഉപഗ്രൂപ്പുകൾ എ), ഒന്നും രണ്ടും കാലഘട്ടങ്ങളിലെ ഘടകങ്ങളിൽ നിന്ന് ആരംഭിക്കുന്നു, കൂടാതെ ഡി-ഘടകങ്ങൾ അടങ്ങിയ ദ്വിതീയ (ഉപഗ്രൂപ്പുകൾ ബി). ഏറ്റവും കുറഞ്ഞ ന്യൂക്ലിയർ ചാർജ് ഉള്ള മൂലകത്തിൻ്റെ പേരിലാണ് ഉപഗ്രൂപ്പുകൾക്ക് പേരു നൽകിയിരിക്കുന്നത് (സാധാരണയായി പ്രധാന ഉപഗ്രൂപ്പുകളുടെ രണ്ടാം കാലഘട്ടത്തിലെ മൂലകവും ദ്വിതീയ ഉപഗ്രൂപ്പുകൾക്ക് നാലാം കാലഘട്ടത്തിലെ ഘടകവും). ഒരേ ഉപഗ്രൂപ്പിലെ മൂലകങ്ങൾക്ക് സമാനമായ രാസ ഗുണങ്ങളുണ്ട്.
ഒരേ ഗ്രൂപ്പിലെ മൂലകങ്ങളുടെ ന്യൂക്ലിയർ ചാർജിൻ്റെ വർദ്ധനവോടെ, ഇലക്ട്രോൺ ഷെല്ലുകളുടെ എണ്ണത്തിലെ വർദ്ധനവ് കാരണം, ആറ്റോമിക് ആരങ്ങൾ വർദ്ധിക്കുന്നു, അതിൻ്റെ ഫലമായി ഇലക്ട്രോനെഗറ്റിവിറ്റി കുറയുന്നു, ലോഹത്തിൻ്റെ വർദ്ധനവ്, ലോഹേതര ഗുണങ്ങളുടെ ദുർബലത എന്നിവ മൂലകങ്ങളുടെ, അവ രൂപപ്പെടുന്ന പദാർത്ഥങ്ങളുടെ ഓക്സിഡേറ്റീവ് ഗുണങ്ങൾ കുറയ്ക്കുന്നതിലും ദുർബലപ്പെടുത്തുന്നതിലും വർദ്ധനവ്.
The Last Dreamer
ഉയർന്ന ബുദ്ധി
(104014)
മുകളിൽ വായിക്കുക.
നിന്ന് ഉത്തരം Yoldar Baizhanov[ഗുരു]
ഇത് ഇലക്ട്രോണുകളുടെയും പ്രോട്ടോണുകളുടെയും എണ്ണം കാണിക്കുന്നു.
നിന്ന് ഉത്തരം 2 ഉത്തരങ്ങൾ[ഗുരു]
ഹലോ! നിങ്ങളുടെ ചോദ്യത്തിനുള്ള ഉത്തരങ്ങളുള്ള വിഷയങ്ങളുടെ ഒരു തിരഞ്ഞെടുപ്പ് ഇതാ: കാലയളവ് നമ്പർ എന്താണ് കാണിക്കുന്നത്? രസതന്ത്രം
രസതന്ത്ര വിഷയത്തെക്കുറിച്ചുള്ള ചോദ്യത്തിന്, ഏതൊരു ദാർശനിക ചോദ്യത്തെയും പോലെ, ചരിത്രപരമായ ഒരു റിട്രോസ്പെക്റ്റീവ് ഉണ്ട്.
പ്രീ-ആൽക്കെമിക്കൽ കാലഘട്ടം
പ്രായോഗിക പ്രവർത്തനത്തിൻ്റെ ഒരു മേഖല എന്ന നിലയിൽ, രസതന്ത്രത്തിന് പുരാതന കാലത്ത് വേരുകളുണ്ട്. നമ്മുടെ യുഗത്തിന് വളരെ മുമ്പുതന്നെ, മനുഷ്യൻ വിവിധ പദാർത്ഥങ്ങളുടെ പരിവർത്തനങ്ങളുമായി പരിചയപ്പെടുകയും അവ തൻ്റെ ആവശ്യങ്ങൾക്കായി ഉപയോഗിക്കാൻ പഠിക്കുകയും ചെയ്തു. രസതന്ത്രത്തിൻ്റെ ഉത്ഭവത്തിൽ അക്കാലത്ത് ബദലായിരുന്ന ആറ്റോമിസ്റ്റിക് സിദ്ധാന്തവും പുരാതന പ്രകൃതി തത്ത്വചിന്തയുടെ മൂലക ഘടകങ്ങളുടെ സിദ്ധാന്തവും ഉൾപ്പെടുന്നു.
ആൽക്കെമിക്കൽ കാലഘട്ടം
3-4 നൂറ്റാണ്ടുകളിൽ എ.ഡി. ഇ. തത്ത്വചിന്തകൻ്റെ കല്ലിൻ്റെ സഹായത്തോടെ അടിസ്ഥാന ലോഹങ്ങളെ ശ്രേഷ്ഠമായവ - സ്വർണ്ണവും വെള്ളിയും ആക്കി മാറ്റാനുള്ള സാധ്യത തിരിച്ചറിഞ്ഞ് അലക്സാണ്ട്രിയയിൽ ആൽക്കെമി ഉടലെടുത്തു. ഈ കാലഘട്ടത്തിലെ രാസ പഠിപ്പിക്കലിലെ പ്രധാന കാര്യം, പദാർത്ഥങ്ങളുടെ വ്യക്തിഗത ഗുണങ്ങളുടെ നിരീക്ഷണവും ഈ പദാർത്ഥങ്ങളുടെ ഘടനയിൽ ഉൾപ്പെടുത്തിയിരിക്കുന്ന പദാർത്ഥങ്ങളുടെ (തത്ത്വങ്ങൾ) സഹായത്തോടെ അവയുടെ വിശദീകരണവുമാണ്.
രസതന്ത്രത്തിൻ്റെ ഏകീകരണ കാലഘട്ടം
15-ഉം 16-ഉം നൂറ്റാണ്ടുകളിൽ, യൂറോപ്പ് വ്യാപാരത്തിലും ഭൗതിക ഉൽപാദനത്തിലും അതിവേഗ വളർച്ചയുടെ ഒരു കാലഘട്ടം ആരംഭിച്ചു. പതിനാറാം നൂറ്റാണ്ടോടെ, യൂറോപ്പിലെ സാങ്കേതികവിദ്യ പുരാതന ലോകത്തിൻ്റെ പ്രതാപകാലത്തെക്കാൾ വളരെ ഉയർന്ന തലത്തിലെത്തി. അതേസമയം, സാങ്കേതിക സാങ്കേതിക വിദ്യകളിലെ മാറ്റങ്ങൾ അവരുടെ സൈദ്ധാന്തിക ധാരണയെക്കാൾ മുന്നിലായിരുന്നു. സാങ്കേതികവിദ്യയുടെ കൂടുതൽ മെച്ചപ്പെടുത്തൽ യുഗത്തിൻ്റെ പ്രധാന വൈരുദ്ധ്യത്തെ ആശ്രയിച്ചിരിക്കുന്നു - അക്കാലത്ത് നേടിയ താരതമ്യേന ഉയർന്ന സാങ്കേതിക അറിവും സൈദ്ധാന്തിക പ്രകൃതിശാസ്ത്രത്തിലെ കുത്തനെയുള്ള കാലതാമസവും തമ്മിലുള്ള വൈരുദ്ധ്യം.
പതിനേഴാം നൂറ്റാണ്ടിൻ്റെ തുടക്കത്തിൽ, പ്രകൃതി ശാസ്ത്രത്തിൻ്റെ വികാസത്തിൽ കാര്യമായ സ്വാധീനം ചെലുത്തിയ പ്രധാന ദാർശനിക കൃതികൾ പ്രത്യക്ഷപ്പെട്ടു. ഇംഗ്ലീഷ് തത്ത്വചിന്തകനായ ഫ്രാൻസിസ് ബേക്കൺ ഒരു ശാസ്ത്രീയ ചർച്ചയിലെ നിർണായക വാദം പരീക്ഷണാത്മകമായിരിക്കണമെന്ന പ്രബന്ധം മുന്നോട്ടുവച്ചു. തത്ത്വചിന്തയിലെ പതിനേഴാം നൂറ്റാണ്ട് ആറ്റോമിസ്റ്റിക് ആശയങ്ങളുടെ പുനരുജ്ജീവനത്താൽ അടയാളപ്പെടുത്തി. ഗണിതശാസ്ത്രജ്ഞനും (വിശകലന ജ്യാമിതിയുടെ സ്ഥാപകനും) തത്ത്വചിന്തകനായ റെനെ ഡെസ്കാർട്ടസും വാദിച്ചത്, എല്ലാ ശരീരങ്ങളും വിവിധ ആകൃതികളിലും വലിപ്പങ്ങളിലുമുള്ള കോർപ്പസ്ക്കിളുകളാണെന്ന്; കോശങ്ങളുടെ ആകൃതി പദാർത്ഥത്തിൻ്റെ ഗുണങ്ങളുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു. അതേസമയം, കോർപ്പസിലുകൾ വിഭജിക്കപ്പെടുമെന്നും ഒരൊറ്റ ദ്രവ്യം ഉൾക്കൊള്ളുന്നുവെന്നും ഡെസ്കാർട്ടസ് വിശ്വസിച്ചു. ശൂന്യതയിൽ ചലിക്കുന്ന അവിഭാജ്യ ആറ്റങ്ങളെക്കുറിച്ചുള്ള ഡെമോക്രിറ്റസിൻ്റെ ആശയങ്ങൾ ഡെസ്കാർട്ടസ് നിഷേധിച്ചു, ശൂന്യതയുടെ അസ്തിത്വം അംഗീകരിക്കാൻ ധൈര്യപ്പെട്ടില്ല. ഫ്രഞ്ച് തത്ത്വചിന്തകനായ പിയറി ഗാസെൻഡിയും എപ്പിക്യൂറസിൻ്റെ പുരാതന ആശയങ്ങളോട് വളരെ അടുത്തുള്ള കോർപ്പസ്കുലർ ആശയങ്ങൾ പ്രകടിപ്പിച്ചു. സംയുക്ത തന്മാത്രകൾ ഉണ്ടാക്കുന്ന ആറ്റങ്ങളുടെ ഗ്രൂപ്പുകളെ ഗാസെൻഡി എന്ന് വിളിക്കുന്നു (ലാറ്റിൽ നിന്ന്. മറുകുകൾ- ഒരു കട്ട). ഗസ്സെൻഡിയുടെ കോർപ്പസ്കുലർ ആശയങ്ങൾ പ്രകൃതി ശാസ്ത്രജ്ഞർക്കിടയിൽ സാമാന്യം വ്യാപകമായ അംഗീകാരം നേടിയിട്ടുണ്ട്.
പതിനേഴാം നൂറ്റാണ്ടിൽ, പുതിയ പരീക്ഷണാത്മക പ്രകൃതി ശാസ്ത്രം ഉയർന്ന തലത്തിലുള്ള സാങ്കേതികവിദ്യയും പ്രകൃതിയെക്കുറിച്ചുള്ള വളരെ താഴ്ന്ന തലത്തിലുള്ള അറിവും തമ്മിലുള്ള വൈരുദ്ധ്യം പരിഹരിക്കുന്നതിനുള്ള ഒരു ഉപകരണമായി മാറി.
പതിനേഴാം നൂറ്റാണ്ടിൻ്റെ രണ്ടാം പകുതിയിൽ സംഭവിച്ച ശാസ്ത്ര വിപ്ലവത്തിൻ്റെ അനന്തരഫലങ്ങളിലൊന്ന് ഒരു പുതിയ ശാസ്ത്ര രസതന്ത്രത്തിൻ്റെ സൃഷ്ടിയായിരുന്നു. രസതന്ത്ര ആശയങ്ങളുടെ പൊരുത്തക്കേട് തെളിയിക്കുകയും ഒരു രാസ മൂലകത്തിൻ്റെ ആശയത്തിന് ആദ്യത്തെ ശാസ്ത്രീയ നിർവചനം നൽകുകയും അതുവഴി ആദ്യമായി രസതന്ത്രത്തെ ശാസ്ത്രത്തിൻ്റെ തലത്തിലേക്ക് ഉയർത്തുകയും ചെയ്ത റോബർട്ട് ബോയിൽ പരമ്പരാഗതമായി ശാസ്ത്ര രസതന്ത്രത്തിൻ്റെ സ്രഷ്ടാവായി കണക്കാക്കപ്പെടുന്നു.
ബ്രിട്ടീഷ് ശാസ്ത്രജ്ഞനായ റോബർട്ട് ബോയിൽ അക്കാലത്തെ ഏറ്റവും വലിയ രസതന്ത്രജ്ഞനും ഭൗതികശാസ്ത്രജ്ഞനും തത്ത്വചിന്തകനുമാണ്. രസതന്ത്രത്തിലെ ബോയിലിൻ്റെ പ്രധാന ശാസ്ത്ര നേട്ടങ്ങളിൽ, അനലിറ്റിക്കൽ കെമിസ്ട്രിയുടെ അടിസ്ഥാനം (ഗുണാത്മക വിശകലനം), ആസിഡുകളുടെ ഗുണങ്ങളെക്കുറിച്ചുള്ള പഠനങ്ങൾ, രാസ പരിശീലനത്തിലേക്ക് സൂചകങ്ങളുടെ പരിചയപ്പെടുത്തൽ, അദ്ദേഹം കണ്ടുപിടിച്ച ഹൈഡ്രോമീറ്റർ ഉപയോഗിച്ച് ദ്രാവകങ്ങളുടെ സാന്ദ്രതയെക്കുറിച്ചുള്ള പഠനം എന്നിവ ഉൾപ്പെടുന്നു. ബോയിൽ കണ്ടെത്തിയ നിയമത്തെ പരാമർശിക്കാതിരിക്കുക അസാധ്യമാണ്, അത് അദ്ദേഹത്തിൻ്റെ പേര് വഹിക്കുന്നു (ബോയിൽ-മാരിയറ്റ് നിയമം എന്നും അറിയപ്പെടുന്നു).
എന്നിരുന്നാലും, ബോയിലിൻ്റെ പ്രധാന യോഗ്യത, "ദി സ്കെപ്റ്റിക്കൽ കെമിസ്റ്റ്" (1661) എന്ന പുസ്തകത്തിൽ വിവരിച്ച കെമിക്കൽ ഫിലോസഫിയുടെ പുതിയ സമ്പ്രദായമായിരുന്നു. രസതന്ത്രത്തിൻ്റെ നിലവിലെ വികസന നിലവാരത്തെ അടിസ്ഥാനമാക്കി, മൂലകങ്ങളെ കൃത്യമായി കണക്കാക്കേണ്ടത് എന്താണെന്ന ചോദ്യത്തിനുള്ള ഉത്തരം തിരയുന്നതിനാണ് പുസ്തകം സമർപ്പിച്ചിരിക്കുന്നത്. ബോയിൽ എഴുതി:
“പ്രത്യേകിച്ച് വിശാലമായ മാനസിക ചക്രവാളം ആവശ്യമില്ലാത്ത അമിതമായ ഇടുങ്ങിയ തത്വങ്ങളാണ് രസതന്ത്രജ്ഞരെ ഇതുവരെ നയിച്ചിരുന്നത്; മരുന്നുകൾ തയ്യാറാക്കുന്നതിലും ലോഹങ്ങളുടെ ഉൽപാദനത്തിലും രൂപാന്തരീകരണത്തിലും അവർ തങ്ങളുടെ ചുമതല കണ്ടു. ഞാൻ രസതന്ത്രത്തെ തികച്ചും വ്യത്യസ്തമായ വീക്ഷണകോണിൽ നിന്നാണ് നോക്കുന്നത്: ഒരു ഡോക്ടറായിട്ടല്ല, ഒരു ആൽക്കെമിസ്റ്റായിട്ടല്ല, ഒരു തത്ത്വചിന്തകൻ എന്ന നിലയിലാണ് അത് നോക്കേണ്ടത്. കെമിക്കൽ ഫിലോസഫിക്കായുള്ള ഒരു പദ്ധതി ഞാൻ ഇവിടെ വിവരിച്ചിട്ടുണ്ട്, അത് എൻ്റെ പരീക്ഷണങ്ങളും നിരീക്ഷണങ്ങളും നടപ്പിലാക്കാനും മെച്ചപ്പെടുത്താനും ഞാൻ പ്രതീക്ഷിക്കുന്നു..
നാല് തത്ത്വചിന്തകർ തമ്മിലുള്ള സംഭാഷണത്തിൻ്റെ രൂപത്തിലാണ് പുസ്തകം ക്രമീകരിച്ചിരിക്കുന്നത്: തീമിസ്റ്റ്, ഒരു പെരിപാറ്ററ്റിക് (അരിസ്റ്റോട്ടിലിൻ്റെ അനുയായി), ഫിലോപോണസ്, ഒരു സ്പാഗിറിസ്റ്റ് (പാരസെൽസസിൻ്റെ പിന്തുണക്കാരൻ), "മിസ്റ്റർ ബോയ്ലിൻ്റെ" വീക്ഷണങ്ങൾ വിശദീകരിക്കുന്ന കാർനേഡ്സ്, എല്യൂതെറിയസ്, തർക്കിക്കുന്നവരുടെ വാദങ്ങളെ നിഷ്പക്ഷമായി വിലയിരുത്തുന്നവൻ. തത്ത്വചിന്തകരുടെ ചർച്ച, അരിസ്റ്റോട്ടിലിൻ്റെ നാല് ഘടകങ്ങളോ ആൽക്കെമിസ്റ്റുകളുടെ മൂന്ന് തത്വങ്ങളോ മൂലകങ്ങളായി അംഗീകരിക്കാൻ കഴിയില്ലെന്ന നിഗമനത്തിലേക്ക് വായനക്കാരനെ നയിച്ചു. ബോയിൽ ഊന്നിപ്പറഞ്ഞു:
"ഒരു പ്രത്യേക ബോഡിക്ക് ഈ അല്ലെങ്കിൽ ആ മൂലകത്തിൻ്റെ പേര് നൽകാൻ ഒരു കാരണവുമില്ല, കാരണം അത് എളുപ്പത്തിൽ ശ്രദ്ധിക്കാവുന്ന ഒരു വസ്തുവിൽ സാമ്യമുള്ളതാണ്; എല്ലാത്തിനുമുപരി, അതേ അവകാശത്തോടെ എനിക്ക് ഈ പേര് നിരസിക്കാം, കാരണം മറ്റ് ഗുണങ്ങൾ വ്യത്യസ്തമാണ്.".
പരീക്ഷണാത്മക ഡാറ്റയെ അടിസ്ഥാനമാക്കി, ആധുനിക രസതന്ത്രത്തിൻ്റെ ആശയങ്ങൾ പരിഷ്കരിക്കേണ്ടതും പരീക്ഷണത്തിന് അനുസൃതമായി കൊണ്ടുവരേണ്ടതും ബോയിൽ കാണിച്ചു.
ബോയിലിൻ്റെ അഭിപ്രായത്തിൽ, മൂലകങ്ങൾ പ്രായോഗികമായി അഴുകാത്ത ശരീരങ്ങളാണ് (പദാർത്ഥങ്ങൾ), സമാനമായ ഏകതാനമായ (പ്രാഥമിക ദ്രവ്യങ്ങൾ അടങ്ങിയ) കോർപ്പസിലുകൾ ഉൾക്കൊള്ളുന്നു, അതിൽ നിന്ന് എല്ലാ സങ്കീർണ്ണമായ ശരീരങ്ങളും രചിക്കപ്പെടുകയും അവ വിഘടിപ്പിക്കുകയും ചെയ്യുന്നു. കോർപ്പസിലുകൾക്ക് ആകൃതിയിലും വലിപ്പത്തിലും പിണ്ഡത്തിലും വ്യത്യാസമുണ്ടാകാം. ശരീരങ്ങൾ രൂപം കൊള്ളുന്ന കോർപ്പസിലുകൾ പിന്നീടുള്ള പരിവർത്തന സമയത്ത് മാറ്റമില്ലാതെ തുടരുന്നു.
പദാർത്ഥങ്ങളുടെ ഘടനയും ഒരു പദാർത്ഥത്തിൻ്റെ ഗുണങ്ങളെ അതിൻ്റെ ഘടനയിൽ ആശ്രയിക്കുന്നതും പഠിക്കുന്നതിൽ രസതന്ത്രത്തിൻ്റെ പ്രധാന ദൌത്യം ബോയ്ൽ കണ്ടു. അതേസമയം, തന്നിരിക്കുന്ന സങ്കീർണ്ണമായ ശരീരത്തിൽ നിന്ന് വേർതിരിച്ച മൂലകങ്ങളിൽ നിന്ന് യഥാർത്ഥ ശരീരം പുനഃസ്ഥാപിക്കാൻ കഴിയുമ്പോൾ മാത്രമേ കോമ്പോസിഷൻ എന്ന ആശയം ഉപയോഗിക്കാൻ കഴിയുമെന്ന് ബോയിൽ കരുതി (അതായത്, വിശകലനത്തിൻ്റെ കൃത്യതയ്ക്കുള്ള മാനദണ്ഡമായി അദ്ദേഹം യഥാർത്ഥത്തിൽ സമന്വയത്തെ സ്വീകരിച്ചു. ). ബോയ്ൽ തൻ്റെ രചനകളിൽ ഈ ആശയത്തിൻ്റെ പുതിയ ധാരണയിൽ ഒരു ഘടകത്തിനും പേരിട്ടിട്ടില്ല; മൂലകങ്ങളുടെ എണ്ണം അദ്ദേഹം സൂചിപ്പിച്ചില്ല, അത് മാത്രം ശ്രദ്ധിക്കുക:
"എണ്ണം മൂന്നോ നാലോ കൂടുതലാണെന്ന് കരുതുന്നത് അസംബന്ധമല്ല".
അതിനാൽ, "ദി സ്കെപ്റ്റിക്കൽ കെമിസ്റ്റ്" എന്ന പുസ്തകം കെമിക്കൽ ഫിലോസഫിയുടെ അമർത്തുന്ന ചോദ്യങ്ങൾക്കുള്ള ഉത്തരമല്ല, മറിച്ച് രസതന്ത്രത്തിന് ഒരു പുതിയ ലക്ഷ്യം സ്ഥാപിക്കുകയാണ്. ബോയിലിൻ്റെ കൃതിയുടെ പ്രധാന പ്രാധാന്യം ഇതാണ്:
1. രസതന്ത്രത്തിൻ്റെ ഒരു പുതിയ ലക്ഷ്യം രൂപപ്പെടുത്തൽ - പദാർത്ഥങ്ങളുടെ ഘടനയും ഒരു വസ്തുവിൻ്റെ ഗുണങ്ങളെ അതിൻ്റെ ഘടനയിൽ ആശ്രയിക്കുന്നതും പഠിക്കുന്നു.
2. യഥാർത്ഥ രാസ ഘടകങ്ങൾ തിരയുന്നതിനും പഠിക്കുന്നതിനുമുള്ള ഒരു പ്രോഗ്രാമിൻ്റെ നിർദ്ദേശം;
3. ഇൻഡക്റ്റീവ് രീതിയുടെ രസതന്ത്രത്തിൻ്റെ ആമുഖം;
പ്രായോഗികമായി അഴുകാത്ത ഒരു പദാർത്ഥമെന്ന നിലയിൽ മൂലകത്തെക്കുറിച്ചുള്ള ബോയിലിൻ്റെ ആശയങ്ങൾ പ്രകൃതി ശാസ്ത്രജ്ഞർക്കിടയിൽ വ്യാപകമായ സ്വീകാര്യത നേടി. എന്നിരുന്നാലും, അരിസ്റ്റോട്ടിലിൻ്റെ പഠിപ്പിക്കലുകളും മെർക്കുറി-സൾഫർ സിദ്ധാന്തവും മാറ്റിസ്ഥാപിക്കാൻ കഴിയുന്ന ശരീരങ്ങളുടെ ഘടനയെക്കുറിച്ചുള്ള സൈദ്ധാന്തിക ആശയങ്ങൾ സൃഷ്ടിക്കുന്നത് വളരെ ബുദ്ധിമുട്ടുള്ള കാര്യമായി മാറി. പതിനേഴാം നൂറ്റാണ്ടിൻ്റെ അവസാന പാദത്തിൽ, എക്ലക്റ്റിക് വീക്ഷണങ്ങൾ പ്രത്യക്ഷപ്പെട്ടു, അതിൻ്റെ സ്രഷ്ടാക്കൾ രസതന്ത്ര പാരമ്പര്യങ്ങളെയും രാസ മൂലകങ്ങളെക്കുറിച്ചുള്ള പുതിയ ആശയങ്ങളെയും ബന്ധിപ്പിക്കാൻ ശ്രമിച്ചു. ഫ്രഞ്ച് രസതന്ത്രജ്ഞനായ നിക്കോളാസ് ലെമറി, പരക്കെ അറിയപ്പെടുന്ന പാഠപുസ്തകമായ "കോഴ്സ് ഓഫ് കെമിസ്ട്രി" യുടെ രചയിതാവിൻ്റെ കാഴ്ചപ്പാടുകൾ അദ്ദേഹത്തിൻ്റെ സമകാലികരെ വളരെയധികം സ്വാധീനിച്ചു.
ലെമെറിയുടെ പാഠപുസ്തകം ആരംഭിച്ചത് രസതന്ത്രം എന്ന വിഷയത്തിൻ്റെ നിർവചനത്തോടെയാണ്:
"സമ്മിശ്ര ശരീരങ്ങളിൽ അടങ്ങിയിരിക്കുന്ന വിവിധ പദാർത്ഥങ്ങളെ എങ്ങനെ വേർതിരിക്കാം എന്ന് പഠിപ്പിക്കുന്ന ഒരു കലയാണ് രസതന്ത്രം. പ്രകൃതിയിൽ രൂപം കൊള്ളുന്നവ, ധാതുക്കൾ, സസ്യങ്ങൾ, മൃഗങ്ങൾ എന്നിവയെ മിശ്രിത ശരീരങ്ങൾ കൊണ്ട് ഞാൻ മനസ്സിലാക്കുന്നു".
അടുത്തതായി, ലെമെറി "രാസ തത്വങ്ങൾ" പട്ടികപ്പെടുത്തി, അതായത് ശരീരങ്ങളുടെ പ്രധാന ഘടകങ്ങൾ. ഒരു നിശ്ചിത "സാർവത്രിക സ്പിരിറ്റ്" (അത് "കുറച്ച് മെറ്റാഫിസിക്കൽ" എന്ന് രചയിതാവ് തന്നെ സമ്മതിക്കുന്നു), ലെമെറി, അഗ്നിയിലൂടെയുള്ള വിശകലനത്തെ അടിസ്ഥാനമാക്കി, പദാർത്ഥങ്ങളുടെ അഞ്ച് അടിസ്ഥാന ഭൗതിക തത്വങ്ങൾ തിരിച്ചറിഞ്ഞു: മദ്യം (അല്ലെങ്കിൽ "മെർക്കുറി"), എണ്ണ (അല്ലെങ്കിൽ "സൾഫർ" ”), ഉപ്പ്, വെള്ളം ("കഫം"), ഭൂമി. ആദ്യത്തെ മൂന്ന് തത്വങ്ങൾ സജീവമാണ്, ജലവും ഭൂമിയും നിഷ്ക്രിയമാണ്.
എന്നിരുന്നാലും, ഈ പദാർത്ഥങ്ങൾ നമുക്ക് "ആരംഭങ്ങൾ" ആണെന്ന് ലെമെറി അഭിപ്രായപ്പെട്ടു, രസതന്ത്രജ്ഞർക്ക് ഈ ശരീരങ്ങളെ കൂടുതൽ വിഘടിപ്പിക്കാൻ കഴിയാത്തതിനാൽ; വ്യക്തമായും, ഈ "ആരംഭങ്ങളെ" ലളിതമായവയായി വിഭജിക്കാം. അങ്ങനെ, തത്ത്വങ്ങളായി അംഗീകരിക്കപ്പെടുന്നത് മിക്സഡ് ബോഡികളെ വേർതിരിക്കുന്നതിലൂടെ ലഭിക്കുന്ന പദാർത്ഥങ്ങളാണ്, രസതന്ത്രജ്ഞരുടെ പക്കലുള്ള മാർഗ്ഗങ്ങൾ ഇത് ചെയ്യാൻ അനുവദിക്കുന്നിടത്തോളം വേർതിരിക്കുന്നു.
17-ഉം 18-ഉം നൂറ്റാണ്ടുകളുടെ തുടക്കത്തിൽ, ശാസ്ത്ര രസതന്ത്രം അതിൻ്റെ യാത്രയുടെ തുടക്കത്തിൽ മാത്രമായിരുന്നു; അതിജീവിക്കേണ്ട ഏറ്റവും പ്രധാനപ്പെട്ട തടസ്സങ്ങൾ ഇപ്പോഴും ശക്തമായ ആൽക്കെമിക്കൽ പാരമ്പര്യങ്ങൾ (ബോയിലോ ലെമെറിയോ രൂപാന്തരീകരണത്തിൻ്റെ അടിസ്ഥാന സാധ്യത നിരസിച്ചില്ല), ലോഹങ്ങളെ വിഘടിപ്പിക്കുന്നതിനെക്കുറിച്ചുള്ള തെറ്റായ ആശയങ്ങൾ, ആറ്റോമിസത്തിൻ്റെ ഊഹക്കച്ചവട (ഊഹക്കച്ചവട) സ്വഭാവം എന്നിവയാണ്.
പതിനെട്ടാം നൂറ്റാണ്ടിലെ തത്ത്വചിന്ത മനസ്സിൻ്റെയും യുക്തിയുടെയും ശാസ്ത്രീയ ചിന്തയുടെയും ഒരു തത്ത്വചിന്തയാണ്. മധ്യകാല സ്കോളാസ്റ്റിസിസത്തിനും സഭാ വിശ്വാസങ്ങളോടുള്ള അന്ധമായ അനുസരണത്തിനും വിരുദ്ധമായി, ശാസ്ത്രീയ അറിവ്, പരിഗണനകൾ, നിരീക്ഷണങ്ങൾ, യുക്തിസഹമായ നിഗമനങ്ങൾ എന്നിവയുടെ സഹായത്തോടെ മനുഷ്യ മനസ്സ് നമുക്ക് ചുറ്റുമുള്ള ലോകത്തെ മനസ്സിലാക്കാൻ ശ്രമിക്കുന്നു. ഇത് രസതന്ത്രത്തെയും ബാധിച്ചു. ശാസ്ത്രീയ രസതന്ത്രത്തിൻ്റെ ആദ്യ സിദ്ധാന്തങ്ങൾ പ്രത്യക്ഷപ്പെടാൻ തുടങ്ങി.
ശാസ്ത്രീയ രസതന്ത്രത്തിൻ്റെ ആദ്യ സിദ്ധാന്തം - ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തം - പ്രധാനമായും പദാർത്ഥങ്ങളുടെ ഘടനയെക്കുറിച്ചും ചില ഗുണങ്ങളുടെ വാഹകരായി മൂലകങ്ങളെക്കുറിച്ചുമുള്ള പരമ്പരാഗത ആശയങ്ങളെ അടിസ്ഥാനമാക്കിയുള്ളതാണ്. എന്നിരുന്നാലും, പതിനെട്ടാം നൂറ്റാണ്ടിൽ മൂലകങ്ങളുടെ സിദ്ധാന്തത്തിൻ്റെ വികാസത്തിനുള്ള പ്രധാന വ്യവസ്ഥയും പ്രധാന പ്രേരകശക്തിയും ആയിത്തീർന്നതും രസതന്ത്രത്തിൽ നിന്ന് രസതന്ത്രത്തിൻ്റെ പൂർണ്ണമായ മോചനത്തിന് സംഭാവന നൽകിയതും ഇതാണ്. ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തത്തിൻ്റെ ഏതാണ്ട് നൂറ്റാണ്ട് നീണ്ട അസ്തിത്വത്തിലാണ് ബോയിൽ ആരംഭിച്ച ആൽക്കെമിയെ രസതന്ത്രമായി രൂപാന്തരപ്പെടുത്തുന്നത്.
ജ്വലനത്തിൻ്റെ ഫ്ളോജിസ്റ്റൺ സിദ്ധാന്തം സൃഷ്ടിച്ചത് ലോഹങ്ങൾ വെടിവയ്ക്കുന്ന പ്രക്രിയകളെ വിവരിക്കുന്നതിനാണ്, പതിനെട്ടാം നൂറ്റാണ്ടിൻ്റെ അവസാനത്തിൽ രസതന്ത്രത്തിലെ ഏറ്റവും പ്രധാനപ്പെട്ട പ്രശ്നങ്ങളിലൊന്നായിരുന്നു ഈ പഠനം. ഈ സമയത്ത് ലോഹശാസ്ത്രം രണ്ട് പ്രശ്നങ്ങൾ അഭിമുഖീകരിച്ചു, ഗുരുതരമായ ശാസ്ത്രീയ ഗവേഷണങ്ങളില്ലാതെ അതിൻ്റെ പരിഹാരം അസാധ്യമാണ് - ലോഹങ്ങൾ ഉരുകുന്നതിലെ വലിയ നഷ്ടവും യൂറോപ്പിലെ വനങ്ങളുടെ ഏതാണ്ട് പൂർണ്ണമായ നാശം മൂലമുണ്ടായ ഇന്ധന പ്രതിസന്ധിയും.
ശരീരത്തിൻ്റെ വിഘടനം എന്ന നിലയിൽ ജ്വലനം എന്ന പരമ്പരാഗത ആശയമായിരുന്നു ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തത്തിൻ്റെ അടിസ്ഥാനം. ലോഹങ്ങൾ വെടിവയ്ക്കുന്നതിൻ്റെ പ്രതിഭാസചിത്രം നന്നായി അറിയാമായിരുന്നു: ലോഹം സ്കെയിലായി മാറുന്നു, അതിൻ്റെ പിണ്ഡം യഥാർത്ഥ ലോഹത്തിൻ്റെ പിണ്ഡത്തേക്കാൾ കൂടുതലാണ്; കൂടാതെ, ജ്വലന സമയത്ത്, അജ്ഞാത പ്രകൃതിയുടെ വാതക ഉൽപ്പന്നങ്ങൾ പുറത്തുവരുന്നു. രാസ സിദ്ധാന്തത്തിൻ്റെ ലക്ഷ്യം ഈ പ്രതിഭാസത്തിൻ്റെ യുക്തിസഹമായ വിശദീകരണമായിരുന്നു, ഇത് നിർദ്ദിഷ്ട സാങ്കേതിക പ്രശ്നങ്ങൾ പരിഹരിക്കാൻ ഉപയോഗിക്കാം. അരിസ്റ്റോട്ടിലിൻ്റെ ആശയങ്ങളോ ജ്വലനത്തെക്കുറിച്ചുള്ള ആൽക്കെമിക്കൽ വീക്ഷണങ്ങളോ അവസാനത്തെ വ്യവസ്ഥ പാലിച്ചില്ല.
ജർമ്മൻ രസതന്ത്രജ്ഞരായ ജോഹാൻ ജോക്കിം ബെച്ചർ, ജോർജ്ജ് ഏണസ്റ്റ് സ്റ്റാൾ എന്നിവരാണ് ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തത്തിൻ്റെ സ്രഷ്ടാക്കൾ. ബെച്ചർ, "അണ്ടർഗ്രൗണ്ട് ഫിസിക്സ്" എന്ന തൻ്റെ പുസ്തകത്തിൽ, ശരീരത്തിൻ്റെ ഘടകഭാഗങ്ങളെക്കുറിച്ചുള്ള തൻ്റെ വളരെ സൂക്ഷ്മമായ വീക്ഷണങ്ങൾ വിവരിച്ചു. അദ്ദേഹത്തിൻ്റെ അഭിപ്രായത്തിൽ, ഇവ മൂന്ന് തരം ഭൂമികളാണ്: ആദ്യത്തേത് ഫ്യൂസിബിൾ, റോക്കി (ടെറ ലാപിഡിയ), രണ്ടാമത്തേത് കൊഴുപ്പുള്ളതും ജ്വലനം ചെയ്യാവുന്നതുമാണ് (ടെറ പിംഗ്വിസ്), മൂന്നാമത്തേത് അസ്ഥിരമാണ് (ടെറ ഫ്ലൂഡ എസ്. മെർക്കുറിയലിസ്). ശരീരങ്ങളുടെ ജ്വലനം, ബെച്ചറിൻ്റെ അഭിപ്രായത്തിൽ, അവയുടെ ഘടനയിൽ രണ്ടാമത്തെ, കൊഴുപ്പുള്ള, ഭൂമിയുടെ സാന്നിധ്യം മൂലമാണ്. സൾഫറിൻ്റെ സാന്നിധ്യം മൂലമാണ് ജ്വലനം സംഭവിക്കുന്ന മൂന്ന് തത്ത്വങ്ങളുടെ ആൽക്കെമിക്കൽ സിദ്ധാന്തവുമായി ബെച്ചറിൻ്റെ സംവിധാനം വളരെ സാമ്യമുള്ളത്; എന്നിരുന്നാലും, സൾഫർ ആസിഡും ടെറ പിംഗ്വിസും ചേർന്ന് രൂപപ്പെടുന്ന ഒരു സങ്കീർണ്ണ ശരീരമാണെന്ന് ബെച്ചർ വിശ്വസിക്കുന്നു. വാസ്തവത്തിൽ, ബെച്ചറുടെ സിദ്ധാന്തം മൂന്ന് തത്വങ്ങളുടെ ആൽക്കെമിക്കൽ സിദ്ധാന്തത്തിന് പകരം പുതിയ എന്തെങ്കിലും നിർദ്ദേശിക്കാനുള്ള ആദ്യ ശ്രമങ്ങളിലൊന്നാണ്. "അഗ്നിദ്രവ്യം" ചേർത്ത് വെടിവയ്ക്കുമ്പോൾ ലോഹത്തിൻ്റെ പിണ്ഡം വർദ്ധിക്കുന്നത് ബെച്ചർ പരമ്പരാഗതമായി വിശദീകരിച്ചു. ബെച്ചറിൻ്റെ ഈ വീക്ഷണങ്ങൾ 1703-ൽ സ്റ്റാൽ നിർദ്ദേശിച്ച ഫ്ളോജിസ്റ്റൺ സിദ്ധാന്തത്തിൻ്റെ നിർമ്മാണത്തിന് ഒരു മുൻവ്യവസ്ഥയായി വർത്തിച്ചു, എന്നിരുന്നാലും അവയുമായി വളരെ കുറച്ച് സാമ്യമേയുള്ളൂ. എന്നിരുന്നാലും, സിദ്ധാന്തത്തിൻ്റെ രചയിതാവ് ബെച്ചറിൻ്റേതാണെന്ന് സ്റ്റാൾ തന്നെ എപ്പോഴും അവകാശപ്പെട്ടു.
ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തത്തിൻ്റെ സാരാംശം ഇനിപ്പറയുന്ന അടിസ്ഥാന തത്വങ്ങളിൽ സംഗ്രഹിക്കാം:
1. എല്ലാ ജ്വലന ശരീരങ്ങളിലും അടങ്ങിയിരിക്കുന്ന ഒരു മെറ്റീരിയൽ ഉണ്ട് - phlogiston (ഗ്രീക്കിൽ നിന്ന് φλογιστοζ - ജ്വലനം).
2. ഫ്ളോജിസ്റ്റണിൻ്റെ പ്രകാശനത്തോടുകൂടിയ ഒരു ശരീരം വിഘടിപ്പിക്കുന്നതാണ് ജ്വലനം, അത് വായുവിലേക്ക് മാറ്റാനാവാത്തവിധം ചിതറിക്കിടക്കുന്നു. കത്തുന്ന ശരീരത്തിൽ നിന്ന് പുറത്തുവരുന്ന ഫ്ലോജിസ്റ്റണിൻ്റെ ചുഴലിക്കാറ്റ് പോലുള്ള ചലനങ്ങൾ ദൃശ്യമായ അഗ്നിയെ പ്രതിനിധീകരിക്കുന്നു. സസ്യങ്ങൾക്ക് മാത്രമേ വായുവിൽ നിന്ന് ഫ്ലോജിസ്റ്റൺ വേർതിരിച്ചെടുക്കാൻ കഴിയൂ.
3. Phlogiston എല്ലായ്പ്പോഴും മറ്റ് പദാർത്ഥങ്ങളുമായി കൂടിച്ചേർന്നതാണ്, മാത്രമല്ല അതിൻ്റെ ശുദ്ധമായ രൂപത്തിൽ വേർതിരിച്ചെടുക്കാൻ കഴിയില്ല; ഫ്ളോജിസ്റ്റണിൽ ഏറ്റവും സമ്പന്നമായ പദാർത്ഥങ്ങൾ അവശിഷ്ടങ്ങൾ അവശേഷിപ്പിക്കാതെ കത്തുന്നവയാണ്.
4. ഫ്ലോജിസ്റ്റണിന് നെഗറ്റീവ് മാസ് ഉണ്ട്.
സ്റ്റാലിൻ്റെ സിദ്ധാന്തം, അതിൻ്റെ എല്ലാ മുൻഗാമികളെയും പോലെ, ഒരു പദാർത്ഥത്തിൻ്റെ ഗുണവിശേഷതകൾ നിർണ്ണയിക്കുന്നത് ഈ ഗുണങ്ങളുടെ ഒരു പ്രത്യേക കാരിയറിൻ്റെ സാന്നിധ്യമാണ് എന്ന ആശയത്തെ അടിസ്ഥാനമാക്കിയുള്ളതാണ്. ഫ്ലോജിസ്റ്റണിൻ്റെ നെഗറ്റീവ് പിണ്ഡത്തെക്കുറിച്ചുള്ള ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തത്തിൻ്റെ സ്ഥാനം, സ്കെയിലിൻ്റെ പിണ്ഡം (അല്ലെങ്കിൽ വാതകം ഉൾപ്പെടെയുള്ള എല്ലാ ജ്വലന ഉൽപ്പന്നങ്ങളും) കത്തിച്ച ലോഹത്തിൻ്റെ പിണ്ഡത്തേക്കാൾ കൂടുതലാണെന്ന വസ്തുത വിശദീകരിക്കാൻ ഉദ്ദേശിച്ചുള്ളതാണ്.
ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തത്തിൻ്റെ ചട്ടക്കൂടിനുള്ളിൽ ഒരു ലോഹത്തെ വെടിവയ്ക്കുന്ന പ്രക്രിയയെ ഒരു രാസ സമവാക്യവുമായി ഇനിപ്പറയുന്ന സാമ്യത്താൽ പ്രതിനിധീകരിക്കാം:
ലോഹം = സ്കെയിൽ + ഫ്ലോജിസ്റ്റൺ
സ്കെയിലിൽ നിന്ന് (അല്ലെങ്കിൽ അയിരിൽ നിന്ന്) ലോഹം ലഭിക്കുന്നതിന്, സിദ്ധാന്തമനുസരിച്ച്, നിങ്ങൾക്ക് ഫ്ളോജിസ്റ്റൺ (അതായത്, അവശിഷ്ടങ്ങൾ ഇല്ലാതെ പൊള്ളൽ) അടങ്ങിയ ഏത് ശരീരവും ഉപയോഗിക്കാം - കരി അല്ലെങ്കിൽ കൽക്കരി, കൊഴുപ്പ്, സസ്യ എണ്ണ മുതലായവ:
സ്കെയിൽ + ഫ്ളോജിസ്റ്റൺ അടങ്ങിയ ശരീരം = ലോഹം
ഈ അനുമാനത്തിൻ്റെ സാധുത സ്ഥിരീകരിക്കാൻ മാത്രമേ പരീക്ഷണത്തിന് കഴിയൂ എന്ന് ഊന്നിപ്പറയേണ്ടതാണ്; ഇത് സ്റ്റാലിൻ്റെ സിദ്ധാന്തത്തിന് അനുകൂലമായ ഒരു നല്ല വാദമായിരുന്നു. ഫ്ളോജിസ്റ്റൺ സിദ്ധാന്തം ഒടുവിൽ ഏതെങ്കിലും ജ്വലന പ്രക്രിയകളിലേക്ക് വ്യാപിപ്പിച്ചു. ജ്വലിക്കുന്ന എല്ലാ ശരീരങ്ങളിലെയും ഫ്ലോജിസ്റ്റണിൻ്റെ ഐഡൻ്റിറ്റി സ്റ്റാൾ പരീക്ഷണാത്മകമായി സ്ഥിരീകരിച്ചു: കൽക്കരി സൾഫ്യൂറിക് ആസിഡിനെ സൾഫറായും ഭൂമിയെ ലോഹമായും കുറയ്ക്കുന്നു. ഇരുമ്പിൻ്റെ ശ്വസനവും തുരുമ്പെടുക്കലും, സ്റ്റാലിൻ്റെ അനുയായികളുടെ അഭിപ്രായത്തിൽ, ഫ്ളോജിസ്റ്റൺ അടങ്ങിയ ശരീരങ്ങളുടെ അതേ വിഘടന പ്രക്രിയയെ പ്രതിനിധീകരിക്കുന്നു, പക്ഷേ ജ്വലനത്തേക്കാൾ സാവധാനത്തിൽ നടക്കുന്നു.
ഫ്ളോജിസ്റ്റണിൻ്റെ സിദ്ധാന്തം, പ്രത്യേകിച്ചും, അയിരിൽ നിന്ന് ലോഹങ്ങൾ ഉരുകുന്ന പ്രക്രിയകൾക്ക് സ്വീകാര്യമായ വിശദീകരണം നൽകുന്നത് സാധ്യമാക്കി, അതിൽ ഇനിപ്പറയുന്നവ ഉൾപ്പെടുന്നു: ചെറിയ ഫ്ളോജിസ്റ്റൺ അടങ്ങിയിരിക്കുന്ന അയിര്, ഫ്ലോജിസ്റ്റണിൽ വളരെ സമ്പന്നമായ കരി ഉപയോഗിച്ച് ചൂടാക്കുന്നു; ഈ സാഹചര്യത്തിൽ, phlogiston കൽക്കരിയിൽ നിന്ന് അയിരിലേക്ക് കടന്നുപോകുന്നു, phlogiston-സമ്പന്നമായ ലോഹവും phlogiston-പാവം ചാരവും രൂപം കൊള്ളുന്നു.
ചരിത്രസാഹിത്യത്തിൽ ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തത്തിൻ്റെ പങ്ക് വിലയിരുത്തുന്നതിൽ ഗുരുതരമായ വിയോജിപ്പുകൾ ഉണ്ടെന്ന് ശ്രദ്ധിക്കേണ്ടതാണ് - കുത്തനെ നെഗറ്റീവ് മുതൽ പോസിറ്റീവ് വരെ. എന്നിരുന്നാലും, ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തത്തിന് സംശയാതീതമായ നിരവധി ഗുണങ്ങളുണ്ടെന്ന് നിഷേധിക്കാനാവില്ല:
- ജ്വലന പ്രക്രിയകളെക്കുറിച്ചുള്ള പരീക്ഷണാത്മക വസ്തുതകൾ ഇത് ലളിതമായും മതിയായമായും വിവരിക്കുന്നു;
- സിദ്ധാന്തം ആന്തരികമായി സ്ഥിരതയുള്ളതാണ്, അതായത്. അനന്തരഫലങ്ങളൊന്നും പ്രധാന വ്യവസ്ഥകൾക്ക് വിരുദ്ധമല്ല;
- ഫ്ളോജിസ്റ്റണിൻ്റെ സിദ്ധാന്തം പൂർണ്ണമായും പരീക്ഷണാത്മക വസ്തുതകളെ അടിസ്ഥാനമാക്കിയുള്ളതാണ്;
- ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തത്തിന് പ്രവചന ശേഷി ഉണ്ടായിരുന്നു.
രസതന്ത്രത്തിൻ്റെ ആദ്യത്തെ യഥാർത്ഥ ശാസ്ത്രീയ സിദ്ധാന്തമായ ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തം സങ്കീർണ്ണമായ ശരീരങ്ങളുടെ അളവ് വിശകലനം വികസിപ്പിക്കുന്നതിനുള്ള ശക്തമായ ഉത്തേജനമായി വർത്തിച്ചു, അതില്ലാതെ രാസ മൂലകങ്ങളെക്കുറിച്ചുള്ള ആശയങ്ങളുടെ പരീക്ഷണാത്മക സ്ഥിരീകരണം തികച്ചും അസാധ്യമാണ്. ഫ്ളോജിസ്റ്റണിൻ്റെ നെഗറ്റീവ് പിണ്ഡത്തെക്കുറിച്ചുള്ള പ്രസ്താവന യഥാർത്ഥത്തിൽ പിണ്ഡത്തിൻ്റെ സംരക്ഷണ നിയമത്തിൻ്റെ അടിസ്ഥാനത്തിലാണ് നിർമ്മിച്ചതെന്ന് ശ്രദ്ധിക്കേണ്ടതാണ്, അത് പിന്നീട് കണ്ടെത്തിയതാണ്. ഈ അനുമാനം തന്നെ അളവ് ഗവേഷണത്തിൻ്റെ കൂടുതൽ തീവ്രതയ്ക്ക് കാരണമായി. ഫ്ളോജിസ്റ്റൺ സിദ്ധാന്തത്തിൻ്റെ സൃഷ്ടിയുടെ മറ്റൊരു ഫലം വാതകങ്ങളുടെ രസതന്ത്രജ്ഞരുടെ സജീവ പഠനമായിരുന്നു, പ്രത്യേകിച്ച് വാതക ജ്വലന ഉൽപ്പന്നങ്ങൾ. പതിനെട്ടാം നൂറ്റാണ്ടിൻ്റെ മധ്യത്തോടെ, ന്യൂമാറ്റിക് കെമിസ്ട്രി രസതന്ത്രത്തിൻ്റെ ഏറ്റവും പ്രധാനപ്പെട്ട ശാഖകളിലൊന്നായി മാറി, അതിൻ്റെ സ്ഥാപകരായ ജോസഫ് ബ്ലാക്ക്, ഡാനിയൽ റഥർഫോർഡ്, ഹെൻറി കാവൻഡിഷ്, ജോസഫ് പ്രീസ്റ്റ്ലി, കാൾ വിൽഹെം ഷീലെ എന്നിവർ രസതന്ത്രത്തിലെ അളവ് രീതികളുടെ ഒരു മുഴുവൻ സംവിധാനത്തിൻ്റെയും സ്രഷ്ടാക്കളായിരുന്നു.
പതിനെട്ടാം നൂറ്റാണ്ടിൻ്റെ രണ്ടാം പകുതിയിൽ, രസതന്ത്രജ്ഞർക്കിടയിൽ ഫ്ളോജിസ്റ്റൺ സിദ്ധാന്തം ഏതാണ്ട് സാർവത്രിക അംഗീകാരം നേടി. ഫ്ലോജിസ്റ്റൺ ആശയങ്ങളെ അടിസ്ഥാനമാക്കി, പദാർത്ഥങ്ങളുടെ ഒരു നാമകരണം രൂപപ്പെട്ടു; ഒരു പദാർത്ഥത്തിൻ്റെ നിറം, സുതാര്യത, ക്ഷാരം മുതലായവ പോലുള്ള ഗുണങ്ങളെ അതിലെ ഫ്ളോജിസ്റ്റണിൻ്റെ ഉള്ളടക്കവുമായി ബന്ധിപ്പിക്കാൻ ശ്രമിച്ചിട്ടുണ്ട്. ഫ്രഞ്ച് രസതന്ത്രജ്ഞനായ പിയറി ജോസഫ് മച്യുർ, "എലമെൻ്റ്സ് ഓഫ് കെമിസ്ട്രി", "കെമിക്കൽ ഡിക്ഷണറി" എന്നീ വളരെ പ്രശസ്തമായ പാഠപുസ്തകങ്ങളുടെ രചയിതാവ്, 1778-ൽ ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തം എഴുതി.
"... കെമിക്കൽ പ്രതിഭാസങ്ങളുമായി ഏറ്റവും വ്യക്തവും ഏറ്റവും സ്ഥിരതയുള്ളതുമാണ്. പ്രകൃതിയുമായി യോജിക്കാതെ ഭാവനയാൽ സൃഷ്ടിക്കപ്പെട്ടതും അനുഭവത്താൽ നശിപ്പിക്കപ്പെട്ടതുമായ സംവിധാനങ്ങളിൽ നിന്ന് വ്യത്യസ്തമാണ്, സ്റ്റാലിൻ്റെ സിദ്ധാന്തം രാസ ഗവേഷണത്തിലെ ഏറ്റവും വിശ്വസനീയമായ മാർഗ്ഗനിർദ്ദേശമാണ്. നിരവധി പരീക്ഷണങ്ങൾ... വിദൂരമല്ല. അത് നിരാകരിക്കുന്നതിൽ നിന്ന്, മറിച്ച്, അവൾക്ക് അനുകൂലമായ തെളിവായി മാറുക".
വിരോധാഭാസമെന്നു പറയട്ടെ, ഫ്ളോജിസ്റ്റൺ സിദ്ധാന്തത്തിൻ്റെ യുഗം അവസാനിക്കാറായ സമയത്താണ് മസീറിൻ്റെ പാഠപുസ്തകവും നിഘണ്ടുവും പ്രത്യക്ഷപ്പെട്ടത്.
ജ്വലനത്തെയും ശ്വസനത്തെയും കുറിച്ചുള്ള നോൺ-ഫ്ലോഗിസ്റ്റൺ ആശയങ്ങൾ ഫ്ലോജിസ്റ്റൺ സിദ്ധാന്തത്തേക്കാൾ അല്പം മുമ്പാണ് ഉയർന്നുവന്നത്. "എല്ലാ ശരീരങ്ങളും ഭാരമുള്ളവയാണ്" എന്ന വാദത്തിന് ശാസ്ത്രം കടപ്പെട്ടിരിക്കുന്ന ജീൻ റേ, 1630-ൽ തന്നെ വെടിവെയ്ക്കുമ്പോൾ ലോഹത്തിൻ്റെ പിണ്ഡം വർദ്ധിക്കുന്നത് വായു ചേർക്കുന്നത് മൂലമാണെന്ന് നിർദ്ദേശിച്ചു. 1665-ൽ റോബർട്ട് ഹുക്ക് തൻ്റെ "മൈക്രോഗ്രാഫി" എന്ന കൃതിയിൽ ഉപ്പുവെള്ളത്തിൽ ബന്ധിതാവസ്ഥയിൽ അടങ്ങിയിരിക്കുന്ന പദാർത്ഥത്തിന് സമാനമായ ഒരു പ്രത്യേക പദാർത്ഥത്തിൻ്റെ വായുവിൽ സാന്നിദ്ധ്യം നിർദ്ദേശിച്ചു.
ഇംഗ്ലീഷ് രസതന്ത്രജ്ഞനായ ജോൺ മയോവ് 1669-ൽ എഴുതിയ "സാൾട്ട്പീറ്റർ ആൻഡ് എയർബോൺ ആൽക്കഹോൾ ഓഫ് സാൾട്ട്പീറ്റർ" എന്ന പുസ്തകത്തിൽ ഈ കാഴ്ചപ്പാടുകൾ കൂടുതൽ വികസിപ്പിച്ചെടുത്തു. വായുവിൽ ജ്വലനത്തെ പിന്തുണയ്ക്കുന്ന ഒരു പ്രത്യേക വാതകം (സ്പിരിറ്റസ് നൈട്രോഎറിയസ്) അടങ്ങിയിട്ടുണ്ടെന്ന് തെളിയിക്കാൻ മയോവ് ശ്രമിച്ചു. മണിയുടെ ചുവട്ടിൽ കത്തുന്ന മെഴുകുതിരി ഉപയോഗിച്ചുള്ള പ്രസിദ്ധമായ പരീക്ഷണങ്ങളിലൂടെ അദ്ദേഹം ഈ അനുമാനത്തെ ശരിവച്ചു. എന്നിരുന്നാലും, ഈ സ്പിരിറ്റസ് നൈട്രോയെറിയസിനെ ഒരു സ്വതന്ത്ര അവസ്ഥയിൽ ഒറ്റപ്പെടുത്താൻ കഴിഞ്ഞത് നൂറിലധികം വർഷങ്ങൾക്ക് ശേഷമാണ്. ഓക്സിജൻ്റെ കണ്ടുപിടിത്തം പല ശാസ്ത്രജ്ഞരും പരസ്പരം സ്വതന്ത്രമായി ഏതാണ്ട് ഒരേസമയം നടത്തി.
കാൾ വിൽഹെം ഷീലെ 1771-ൽ ഓക്സിജൻ നേടി, അതിനെ "അഗ്നിവായു" എന്ന് വിളിച്ചു; എന്നിരുന്നാലും, ഷീലെയുടെ പരീക്ഷണങ്ങളുടെ ഫലങ്ങൾ 1777-ൽ മാത്രമാണ് പ്രസിദ്ധീകരിച്ചത്. ഷീലെയുടെ അഭിപ്രായത്തിൽ, "അഗ്നിവായു" "ഫ്ളോജിസ്റ്റണുമായി ചേർന്ന ഒരു അസിഡിക് നേർത്ത ദ്രവ്യമാണ്".
ജോസഫ് പ്രീസ്റ്റ്ലി 1774-ൽ മെർക്കുറിക് ഓക്സൈഡ് ചൂടാക്കി ഓക്സിജൻ വേർതിരിച്ചു. തനിക്ക് ലഭിച്ച വാതകം പൂർണ്ണമായും ഫ്ളോജിസ്റ്റൺ ഇല്ലാത്ത വായു ആണെന്ന് പ്രീസ്റ്റ്ലി വിശ്വസിച്ചു, അതിൻ്റെ ഫലമായി സാധാരണ വായുവിനേക്കാൾ ഈ "ഡീഫ്ലോജിസ്റ്റേറ്റഡ് എയർ" യിൽ ജ്വലനം നന്നായി നടക്കുന്നു.
കൂടാതെ, 1766-ൽ കാവൻഡിഷ് ഹൈഡ്രജനും 1772-ൽ റഥർഫോർഡ് നൈട്രജനും കണ്ടെത്തി (കാവൻഡിഷ് ഹൈഡ്രജനെ ശുദ്ധമായ ഫ്ലോജിസ്റ്റണായി തെറ്റിദ്ധരിച്ചു എന്നത് ശ്രദ്ധിക്കേണ്ടതാണ്) ജ്വലനത്തിൻ്റെ ഓക്സിജൻ സിദ്ധാന്തം സൃഷ്ടിക്കുന്നതിന് വലിയ പ്രാധാന്യമുണ്ടായിരുന്നു.
ഷീലെയും പ്രീസ്റ്റ്ലിയും നടത്തിയ കണ്ടെത്തലിൻ്റെ പ്രാധാന്യം ഫ്രഞ്ച് രസതന്ത്രജ്ഞനായ അൻ്റോയിൻ ലോറൻ്റ് ലാവോസിയർ ശരിയായി വിലയിരുത്താൻ കഴിഞ്ഞു. 1774-ൽ ലാവോസിയർ "ഭൗതികശാസ്ത്രത്തെയും രസതന്ത്രത്തെയും കുറിച്ചുള്ള ചെറിയ കൃതികൾ" എന്ന ഗ്രന്ഥം പ്രസിദ്ധീകരിച്ചു, അവിടെ ജ്വലന സമയത്ത് അന്തരീക്ഷ വായുവിൻ്റെ ഒരു ഭാഗം ശരീരങ്ങളിലേക്ക് ചേർക്കണമെന്ന് അദ്ദേഹം നിർദ്ദേശിച്ചു. 1774-ൽ പ്രീസ്റ്റ്ലി പാരീസ് സന്ദർശിച്ച് ലാവോസിയറിനോട് "ഡീഫ്ലോജിസ്റ്റിക് എയർ" കണ്ടുപിടിച്ചതിനെ കുറിച്ച് പറഞ്ഞതിന് ശേഷം, ലാവോസിയർ തൻ്റെ പരീക്ഷണങ്ങൾ ആവർത്തിച്ച് 1775-ൽ "ലോഹങ്ങളുമായി സംയോജിച്ച് അവയുടെ ഭാരം വർദ്ധിപ്പിക്കുന്ന ഒരു വസ്തുവിൻ്റെ സ്വഭാവത്തെക്കുറിച്ച്" എന്ന കൃതി പ്രസിദ്ധീകരിച്ചു. ഓക്സിജൻ്റെ കണ്ടുപിടിത്തത്തിൻ്റെ മുൻഗണന തനിക്കാണെന്ന് അവകാശപ്പെട്ടു). ഒടുവിൽ, 1777-ൽ, ലവോസിയർ ജ്വലനത്തിൻ്റെ ഓക്സിജൻ സിദ്ധാന്തത്തിൻ്റെ പ്രധാന തത്വങ്ങൾ രൂപപ്പെടുത്തി:
1. ശരീരങ്ങൾ "ശുദ്ധവായു" യിൽ മാത്രം കത്തിക്കുന്നു.
2. ജ്വലന സമയത്ത് "ശുദ്ധവായു" ആഗിരണം ചെയ്യപ്പെടുന്നു, പൊള്ളലേറ്റ ശരീരത്തിൻ്റെ പിണ്ഡത്തിൻ്റെ വർദ്ധനവ് വായുവിൻ്റെ പിണ്ഡം കുറയുന്നതിന് തുല്യമാണ്.
3. ചൂടാക്കിയാൽ ലോഹങ്ങൾ "ഭൂമികൾ" ആയി മാറുന്നു. സൾഫർ അല്ലെങ്കിൽ ഫോസ്ഫറസ്, "ശുദ്ധവായു" യുമായി സംയോജിപ്പിച്ച് ആസിഡുകളായി മാറുന്നു.
ജ്വലനത്തിൻ്റെ പുതിയ ഓക്സിജൻ സിദ്ധാന്തത്തിന് (ഓക്സിജൻ - ഓക്സിജൻ - 1877-ൽ ലാവോസിയറിൻ്റെ "ആസിഡുകളുടെ സ്വഭാവത്തെയും അവയുടെ സംയോജന തത്വങ്ങളെയും കുറിച്ചുള്ള പൊതുവായ പരിഗണന" എന്ന കൃതിയിൽ പ്രത്യക്ഷപ്പെട്ടു) ഫ്ലോജിസ്റ്റിക് സിദ്ധാന്തത്തേക്കാൾ നിരവധി പ്രധാന ഗുണങ്ങളുണ്ട്. ഇത് ഫ്ലോജിസ്റ്റണേക്കാൾ ലളിതമാണ്, ശരീരത്തിലെ നെഗറ്റീവ് പിണ്ഡത്തിൻ്റെ സാന്നിധ്യത്തെക്കുറിച്ച് "പ്രകൃതിവിരുദ്ധ" അനുമാനങ്ങൾ അടങ്ങിയിട്ടില്ല, ഏറ്റവും പ്രധാനമായി, പരീക്ഷണാത്മകമായി വേർതിരിച്ചിട്ടില്ലാത്ത വസ്തുക്കളുടെ അസ്തിത്വത്തെ അടിസ്ഥാനമാക്കിയുള്ളതല്ല. തൽഫലമായി, ജ്വലനത്തെക്കുറിച്ചുള്ള ഓക്സിജൻ സിദ്ധാന്തം പ്രകൃതി ശാസ്ത്രജ്ഞർക്കിടയിൽ വളരെ വേഗത്തിൽ സ്വീകാര്യത നേടി (ലവോസിയറും ഫ്ളോജിസ്റ്റിക്സും തമ്മിലുള്ള തർക്കം വർഷങ്ങളോളം തുടർന്നുവെങ്കിലും).
പതിനെട്ടാം നൂറ്റാണ്ടിൻ്റെ അവസാനത്തിലും പത്തൊൻപതാം നൂറ്റാണ്ടിൻ്റെ തുടക്കത്തിലും, സയൻറിസം (ശാസ്ത്രത്തിൽ നിന്ന്) എന്ന ഒരു പ്രസ്ഥാനം തത്ത്വചിന്തയിൽ നിലനിന്നിരുന്നു, അത് ശാസ്ത്രത്തോടുള്ള ആരാധനയിലും ശാസ്ത്രത്തോടുള്ള ആരാധനയിലും മനുഷ്യ അറിവിലും പ്രകടമാണ്. ഒരു വ്യക്തി തൻ്റെ അറിവിലും ബുദ്ധിയിലും സ്വാതന്ത്ര്യത്തിലും അഭിമാനിക്കുന്നു, കൂടാതെ ഉയർന്നുവരുന്ന എല്ലാ പ്രശ്നങ്ങളും പരിഹരിക്കാനുള്ള അവൻ്റെ കഴിവിൽ ആത്മവിശ്വാസമുണ്ട്. അക്കാദമികൾ ശാസ്ത്ര പ്രവർത്തനത്തിൻ്റെ പ്രധാന കേന്ദ്രങ്ങളായി. ഈ സമയത്ത്, രാസ ശാസ്ത്രത്തിൽ ഒരു വിപ്ലവം നടക്കുന്നു.
ഓക്സിജൻ സിദ്ധാന്തത്തിൻ്റെ പ്രാധാന്യം ജ്വലനത്തിൻ്റെയും ശ്വസനത്തിൻ്റെയും പ്രതിഭാസങ്ങളുടെ വിശദീകരണത്തേക്കാൾ വളരെ വലുതായി മാറി. ഫ്ളോജിസ്റ്റൺ സിദ്ധാന്തം നിരസിക്കാൻ രസതന്ത്രത്തിൻ്റെ എല്ലാ അടിസ്ഥാന തത്വങ്ങളുടെയും ആശയങ്ങളുടെയും പുനരവലോകനം, പദാവലിയിലും പദാർത്ഥങ്ങളുടെ നാമകരണത്തിലും മാറ്റം ആവശ്യമാണ്. അതിനാൽ, ഓക്സിജൻ സിദ്ധാന്തത്തിൻ്റെ സൃഷ്ടിയോടെ, രസതന്ത്രത്തിൻ്റെ വികാസത്തിലെ ഒരു വഴിത്തിരിവ് ആരംഭിച്ചു, അതിനെ "രാസ വിപ്ലവം" എന്ന് വിളിക്കുന്നു.
1785-1787 ൽ നാല് മികച്ച ഫ്രഞ്ച് രസതന്ത്രജ്ഞർ - അൻ്റോയിൻ ലോറൻ്റ് ലാവോസിയർ, ക്ലോഡ് ലൂയിസ് ബെർത്തോലെറ്റ്, ലൂയിസ് ബെർണാഡ് ഗിറ്റോൺ ഡി മോർവോ, അൻ്റോയിൻ ഫ്രാങ്കോയിസ് ഡി ഫോർക്രോയ് - പാരീസ് അക്കാദമി ഓഫ് സയൻസസിന് വേണ്ടി, രാസ നാമകരണത്തിൻ്റെ ഒരു പുതിയ സംവിധാനം വികസിപ്പിച്ചെടുത്തു. പുതിയ നാമകരണത്തിൻ്റെ യുക്തി, പദാർത്ഥം ഉൾക്കൊള്ളുന്ന മൂലകങ്ങളുടെ പേരുകളെ അടിസ്ഥാനമാക്കി ഒരു പദാർത്ഥത്തിൻ്റെ പേര് നിർമ്മിക്കുന്നത് ഉൾപ്പെടുന്നു. ഈ നാമകരണത്തിൻ്റെ അടിസ്ഥാന തത്വങ്ങൾ ഇന്നും ഉപയോഗിക്കുന്നു.
ഒരു കാലഘട്ടം എന്നത് രാസ മൂലകങ്ങളുടെ ആനുകാലിക വ്യവസ്ഥയുടെ ഒരു നിരയാണ്, ന്യൂക്ലിയർ ചാർജ് വർദ്ധിപ്പിക്കുന്നതിനും പുറം ഇലക്ട്രോൺ ഷെല്ലിൽ ഇലക്ട്രോണുകൾ നിറയ്ക്കുന്നതിനുമുള്ള ആറ്റങ്ങളുടെ ഒരു ശ്രേണി.
ആവർത്തനപ്പട്ടികയിൽ ഏഴ് കാലഘട്ടങ്ങളുണ്ട്. 2 മൂലകങ്ങൾ അടങ്ങുന്ന ആദ്യ കാലഘട്ടം, അതുപോലെ തന്നെ 8 മൂലകങ്ങൾ വീതമുള്ള രണ്ടാമത്തെയും മൂന്നാമത്തേയും ചെറുത് എന്ന് വിളിക്കുന്നു. 18 അല്ലെങ്കിൽ അതിലധികമോ മൂലകങ്ങളുള്ള ശേഷിക്കുന്ന കാലഘട്ടങ്ങൾ വലുതാണ്. ഏഴാമത്തെ പിരീഡ് പൂർത്തിയായിട്ടില്ല. ഒരു രാസ മൂലകം ഉൾപ്പെടുന്ന കാലഘട്ടത്തിൻ്റെ എണ്ണം നിർണ്ണയിക്കുന്നത് അതിൻ്റെ ഇലക്ട്രോൺ ഷെല്ലുകളുടെ എണ്ണമാണ്.
ഓരോ കാലഘട്ടവും ഒരു സാധാരണ ലോഹത്തിൽ നിന്ന് ആരംഭിച്ച് ഒരു നോബിൾ വാതകത്തിൽ അവസാനിക്കുന്നു, ഒരു സാധാരണ നോൺ-മെറ്റലിന് മുമ്പായി.
ആദ്യ കാലഘട്ടത്തിൽ, ഹീലിയം കൂടാതെ, ഒരേയൊരു മൂലകം മാത്രമേയുള്ളൂ - ഹൈഡ്രജൻ, ലോഹങ്ങളുടെയും അലോഹങ്ങളുടെയും സ്വഭാവസവിശേഷതകൾ സംയോജിപ്പിക്കുന്നു. ഈ മൂലകങ്ങളുടെ 1s സബ്ഷെൽ ഇലക്ട്രോണുകളാൽ നിറഞ്ഞിരിക്കുന്നു.
രണ്ടാമത്തെയും മൂന്നാമത്തെയും കാലഘട്ടങ്ങളിലെ ഘടകങ്ങൾക്ക്, s-, p-സബ്ഷെല്ലുകൾ തുടർച്ചയായി പൂരിപ്പിക്കുന്നു. ന്യൂക്ലിയർ ചാർജുകൾ വർദ്ധിക്കുന്നതിനൊപ്പം ഇലക്ട്രോനെഗറ്റിവിറ്റിയിൽ വളരെ വേഗത്തിലുള്ള വർദ്ധനവ്, ലോഹ ഗുണങ്ങളുടെ ദുർബലത, ലോഹേതര ഗുണങ്ങളുടെ വർദ്ധനവ് എന്നിവയാണ് ഹ്രസ്വകാല മൂലകങ്ങളുടെ സവിശേഷത.
നാലാമത്തെയും അഞ്ചാമത്തെയും കാലഘട്ടങ്ങളിൽ പതിറ്റാണ്ടുകളായി സംക്രമണ ഡി-മൂലകങ്ങൾ അടങ്ങിയിരിക്കുന്നു, അതിൽ, ഇലക്ട്രോണുകൾ ഉപയോഗിച്ച് ബാഹ്യ എസ്-സബ്ഷെൽ നിറച്ച ശേഷം, ക്ലെച്ച്കോവ്സ്കി നിയമം അനുസരിച്ച്, മുൻ ഊർജ്ജ നിലയുടെ ഡി-സബ്ഷെൽ നിറഞ്ഞിരിക്കുന്നു.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 6f 7d 7f ...
ആറാമത്തെയും ഏഴാമത്തെയും കാലഘട്ടങ്ങളിൽ, 4f-ഉം 5f-ഉം-സബ്ഷെല്ലുകൾ പൂരിതമാകുന്നു, അതിൻ്റെ ഫലമായി അവയിൽ 4-ഉം 5-ഉം കാലഘട്ടങ്ങളെ അപേക്ഷിച്ച് 14 ഘടകങ്ങൾ കൂടി അടങ്ങിയിരിക്കുന്നു.
ദൈർഘ്യത്തിലും മറ്റ് സ്വഭാവസവിശേഷതകളിലുമുള്ള കാലഘട്ടങ്ങളിലെ വ്യത്യാസങ്ങൾ കാരണം, ആനുകാലിക വ്യവസ്ഥയിൽ അവയുടെ ആപേക്ഷിക ക്രമീകരണത്തിൻ്റെ വ്യത്യസ്ത വഴികളുണ്ട്. ഹ്രസ്വകാല പതിപ്പിൽ, ഹ്രസ്വകാലങ്ങളിൽ ഒരു വരി ഘടകങ്ങൾ അടങ്ങിയിരിക്കുന്നു, വലിയ കാലയളവുകൾക്ക് രണ്ട് വരികളുണ്ട്. ദീർഘകാല പതിപ്പിൽ, എല്ലാ കാലഘട്ടങ്ങളും ഒരു പരമ്പര ഉൾക്കൊള്ളുന്നു. ലാന്തനൈഡ്, ആക്ടിനൈഡ് ശ്രേണികൾ സാധാരണയായി പട്ടികയുടെ അടിയിൽ വെവ്വേറെ എഴുതിയിരിക്കുന്നു.
ഒരേ കാലഘട്ടത്തിലെ മൂലകങ്ങൾക്ക് സമാനമായ ആറ്റോമിക പിണ്ഡമുണ്ട്, എന്നാൽ ഒരേ ഗ്രൂപ്പിലെ മൂലകങ്ങളിൽ നിന്ന് വ്യത്യസ്തമായി വ്യത്യസ്ത ഭൗതികവും രാസപരവുമായ ഗുണങ്ങളുണ്ട്. അതേ കാലഘട്ടത്തിലെ മൂലകങ്ങളുടെ ന്യൂക്ലിയർ ചാർജിൻ്റെ വർദ്ധനവോടെ, ആറ്റോമിക് ആരം കുറയുകയും വാലൻസ് ഇലക്ട്രോണുകളുടെ എണ്ണം വർദ്ധിക്കുകയും ചെയ്യുന്നു, അതിൻ്റെ ഫലമായി മൂലകങ്ങളുടെ ലോഹവും അലോഹവുമായ ഗുണങ്ങൾ ദുർബലമാവുകയും കുറയ്ക്കുന്ന ഗുണങ്ങൾ ദുർബലമാവുകയും ചെയ്യുന്നു. അവ ഉണ്ടാക്കുന്ന പദാർത്ഥങ്ങളുടെ ഓക്സിഡേറ്റീവ് ഗുണങ്ങൾ ശക്തിപ്പെടുത്തുന്നു.
നിങ്ങൾക്ക് ആവർത്തനപ്പട്ടിക മനസ്സിലാക്കാൻ ബുദ്ധിമുട്ടാണെങ്കിൽ, നിങ്ങൾ ഒറ്റയ്ക്കല്ല! അതിൻ്റെ തത്വങ്ങൾ മനസ്സിലാക്കാൻ പ്രയാസമാണെങ്കിലും, അത് എങ്ങനെ ഉപയോഗിക്കണമെന്ന് പഠിക്കുന്നത് ശാസ്ത്രം പഠിക്കുമ്പോൾ നിങ്ങളെ സഹായിക്കും. ആദ്യം, പട്ടികയുടെ ഘടന പഠിക്കുക, ഓരോ രാസ മൂലകത്തെക്കുറിച്ചും അതിൽ നിന്ന് നിങ്ങൾക്ക് എന്ത് വിവരങ്ങൾ പഠിക്കാനാകും. അപ്പോൾ നിങ്ങൾക്ക് ഓരോ മൂലകത്തിൻ്റെയും സവിശേഷതകൾ പഠിക്കാൻ തുടങ്ങാം. അവസാനമായി, ആവർത്തന പട്ടിക ഉപയോഗിച്ച്, ഒരു പ്രത്യേക രാസ മൂലകത്തിൻ്റെ ആറ്റത്തിലെ ന്യൂട്രോണുകളുടെ എണ്ണം നിങ്ങൾക്ക് നിർണ്ണയിക്കാനാകും.
പടികൾ
ഭാഗം 1
പട്ടിക ഘടന-
നിങ്ങൾക്ക് കാണാനാകുന്നതുപോലെ, തുടർന്നുള്ള ഓരോ മൂലകത്തിലും അതിന് മുമ്പുള്ള മൂലകത്തേക്കാൾ ഒരു പ്രോട്ടോൺ കൂടുതൽ അടങ്ങിയിരിക്കുന്നു.ആറ്റോമിക് നമ്പറുകൾ പരിശോധിക്കുമ്പോൾ ഇത് വ്യക്തമാണ്. നിങ്ങൾ ഇടത്തുനിന്ന് വലത്തോട്ട് നീങ്ങുമ്പോൾ ആറ്റോമിക സംഖ്യകൾ ഒന്നായി വർദ്ധിക്കുന്നു. ഘടകങ്ങൾ ഗ്രൂപ്പുകളായി ക്രമീകരിച്ചിരിക്കുന്നതിനാൽ, ചില ടേബിൾ സെല്ലുകൾ ശൂന്യമായി അവശേഷിക്കുന്നു.
- ഉദാഹരണത്തിന്, പട്ടികയുടെ ആദ്യ നിരയിൽ ആറ്റോമിക നമ്പർ 1 ഉള്ള ഹൈഡ്രജനും ആറ്റോമിക നമ്പർ 2 ഉള്ള ഹീലിയവും അടങ്ങിയിരിക്കുന്നു. എന്നിരുന്നാലും, അവ വ്യത്യസ്ത ഗ്രൂപ്പുകളിൽ പെട്ടതിനാൽ അവ എതിർ അരികുകളിൽ സ്ഥിതിചെയ്യുന്നു.
-
സമാനമായ ഭൗതിക രാസ ഗുണങ്ങളുള്ള മൂലകങ്ങൾ അടങ്ങിയ ഗ്രൂപ്പുകളെക്കുറിച്ച് അറിയുക.ഓരോ ഗ്രൂപ്പിൻ്റെയും ഘടകങ്ങൾ അനുബന്ധ ലംബ നിരയിൽ സ്ഥിതിചെയ്യുന്നു. അവ സാധാരണയായി ഒരേ നിറത്താൽ തിരിച്ചറിയപ്പെടുന്നു, ഇത് സമാന ഭൗതികവും രാസപരവുമായ ഗുണങ്ങളുള്ള മൂലകങ്ങളെ തിരിച്ചറിയാനും അവയുടെ സ്വഭാവം പ്രവചിക്കാനും സഹായിക്കുന്നു. ഒരു പ്രത്യേക ഗ്രൂപ്പിലെ എല്ലാ മൂലകങ്ങൾക്കും അവയുടെ പുറം ഷെല്ലിൽ ഒരേ എണ്ണം ഇലക്ട്രോണുകൾ ഉണ്ട്.
- ഹൈഡ്രജനെ ആൽക്കലി ലോഹങ്ങൾ, ഹാലൊജനുകൾ എന്നിങ്ങനെ രണ്ടായി തരം തിരിക്കാം. ചില പട്ടികകളിൽ ഇത് രണ്ട് ഗ്രൂപ്പുകളിലും സൂചിപ്പിച്ചിരിക്കുന്നു.
- മിക്ക കേസുകളിലും, ഗ്രൂപ്പുകൾ 1 മുതൽ 18 വരെ അക്കമിട്ടിരിക്കുന്നു, കൂടാതെ അക്കങ്ങൾ പട്ടികയുടെ മുകളിലോ താഴെയോ സ്ഥാപിച്ചിരിക്കുന്നു. റോമൻ (ഉദാ. IA) അല്ലെങ്കിൽ അറബിക് (ഉദാ: 1A അല്ലെങ്കിൽ 1) അക്കങ്ങളിൽ സംഖ്യകൾ വ്യക്തമാക്കാം.
- മുകളിൽ നിന്ന് താഴേക്ക് ഒരു നിരയിലൂടെ നീങ്ങുമ്പോൾ, നിങ്ങൾ "ഒരു ഗ്രൂപ്പ് ബ്രൗസ് ചെയ്യുന്നു" എന്ന് പറയപ്പെടുന്നു.
-
പട്ടികയിൽ ശൂന്യമായ സെല്ലുകൾ ഉള്ളത് എന്തുകൊണ്ടെന്ന് കണ്ടെത്തുക.മൂലകങ്ങൾ അവയുടെ ആറ്റോമിക നമ്പർ അനുസരിച്ച് മാത്രമല്ല, ഗ്രൂപ്പ് അനുസരിച്ച് ക്രമീകരിച്ചിരിക്കുന്നു (ഒരേ ഗ്രൂപ്പിലെ മൂലകങ്ങൾക്ക് സമാനമായ ഭൗതികവും രാസപരവുമായ ഗുണങ്ങളുണ്ട്). ഇതിന് നന്ദി, ഒരു പ്രത്യേക ഘടകം എങ്ങനെ പ്രവർത്തിക്കുന്നുവെന്ന് മനസിലാക്കാൻ എളുപ്പമാണ്. എന്നിരുന്നാലും, ആറ്റോമിക നമ്പർ വർദ്ധിക്കുന്നതിനനുസരിച്ച്, അനുബന്ധ ഗ്രൂപ്പിലേക്ക് വരുന്ന മൂലകങ്ങൾ എല്ലായ്പ്പോഴും കണ്ടെത്തിയില്ല, അതിനാൽ പട്ടികയിൽ ശൂന്യമായ സെല്ലുകൾ ഉണ്ട്.
- ഉദാഹരണത്തിന്, ആദ്യത്തെ 3 വരികളിൽ ശൂന്യമായ സെല്ലുകൾ ഉണ്ട്, കാരണം സംക്രമണ ലോഹങ്ങൾ ആറ്റോമിക് നമ്പർ 21 ൽ നിന്ന് മാത്രമേ കാണപ്പെടുന്നുള്ളൂ.
- 57 മുതൽ 102 വരെയുള്ള ആറ്റോമിക സംഖ്യകളുള്ള മൂലകങ്ങളെ അപൂർവ ഭൂമി മൂലകങ്ങളായി തരം തിരിച്ചിരിക്കുന്നു, അവ സാധാരണയായി പട്ടികയുടെ താഴെ വലത് കോണിലുള്ള സ്വന്തം ഉപഗ്രൂപ്പിൽ സ്ഥാപിക്കുന്നു.
-
പട്ടികയുടെ ഓരോ വരിയും ഒരു കാലഘട്ടത്തെ പ്രതിനിധീകരിക്കുന്നു.ഒരേ കാലഘട്ടത്തിലെ എല്ലാ മൂലകങ്ങൾക്കും ഒരേ എണ്ണം ആറ്റോമിക് ഓർബിറ്റലുകൾ ഉണ്ട്, അതിൽ ആറ്റങ്ങളിലെ ഇലക്ട്രോണുകൾ സ്ഥിതിചെയ്യുന്നു. ഭ്രമണപഥങ്ങളുടെ എണ്ണം കാലയളവിൻ്റെ സംഖ്യയുമായി പൊരുത്തപ്പെടുന്നു. പട്ടികയിൽ 7 വരികൾ അടങ്ങിയിരിക്കുന്നു, അതായത് 7 പിരീഡുകൾ.
- ഉദാഹരണത്തിന്, ആദ്യ കാലഘട്ടത്തിലെ മൂലകങ്ങളുടെ ആറ്റങ്ങൾക്ക് ഒരു പരിക്രമണപഥവും ഏഴാം കാലഘട്ടത്തിലെ മൂലകങ്ങളുടെ ആറ്റങ്ങൾക്ക് 7 പരിക്രമണങ്ങളുമുണ്ട്.
- ചട്ടം പോലെ, പട്ടികയുടെ ഇടതുവശത്ത് 1 മുതൽ 7 വരെയുള്ള അക്കങ്ങളാൽ കാലയളവുകൾ നിയുക്തമാക്കിയിരിക്കുന്നു.
- നിങ്ങൾ ഇടത്തുനിന്ന് വലത്തോട്ട് ഒരു വരിയിലൂടെ നീങ്ങുമ്പോൾ, നിങ്ങൾ "കാലഘട്ടം സ്കാൻ ചെയ്യുന്നു" എന്ന് പറയപ്പെടുന്നു.
-
ലോഹങ്ങൾ, മെറ്റലോയിഡുകൾ, അലോഹങ്ങൾ എന്നിവ തമ്മിൽ വേർതിരിച്ചറിയാൻ പഠിക്കുക.ഒരു മൂലകത്തിൻ്റെ സവിശേഷതകൾ നിങ്ങൾക്ക് നന്നായി മനസ്സിലാക്കാൻ കഴിയും, അത് ഏത് തരത്തിലുള്ളതാണെന്ന് നിങ്ങൾക്ക് നിർണ്ണയിക്കാനാകും. സൗകര്യാർത്ഥം, മിക്ക ടേബിളുകളിലും ലോഹങ്ങൾ, മെറ്റലോയിഡുകൾ, നോൺമെറ്റലുകൾ എന്നിവ വ്യത്യസ്ത നിറങ്ങളാൽ നിയുക്തമാക്കിയിരിക്കുന്നു. മേശയുടെ ഇടതുവശത്ത് ലോഹങ്ങളും വലതുവശത്ത് ലോഹങ്ങളല്ലാത്തവയുമാണ്. മെറ്റലോയിഡുകൾ അവയ്ക്കിടയിൽ സ്ഥിതിചെയ്യുന്നു.
ഭാഗം 2
മൂലക പദവികൾ-
ഓരോ മൂലകവും ഒന്നോ രണ്ടോ ലാറ്റിൻ അക്ഷരങ്ങളാൽ നിയുക്തമാക്കിയിരിക്കുന്നു.ചട്ടം പോലെ, മൂലക ചിഹ്നം അനുബന്ധ സെല്ലിൻ്റെ മധ്യഭാഗത്ത് വലിയ അക്ഷരങ്ങളിൽ കാണിച്ചിരിക്കുന്നു. മിക്ക ഭാഷകളിലും സമാനമായ ഒരു മൂലകത്തിൻ്റെ ചുരുക്കിയ പേരാണ് ചിഹ്നം. പരീക്ഷണങ്ങൾ നടത്തുമ്പോഴും രാസ സമവാക്യങ്ങളുമായി പ്രവർത്തിക്കുമ്പോഴും മൂലക ചിഹ്നങ്ങൾ സാധാരണയായി ഉപയോഗിക്കുന്നു, അതിനാൽ അവ ഓർമ്മിക്കുന്നത് സഹായകമാണ്.
- സാധാരണഗതിയിൽ, മൂലക ചിഹ്നങ്ങൾ അവയുടെ ലാറ്റിൻ പേരിൻ്റെ ചുരുക്കെഴുത്താണ്, എന്നിരുന്നാലും ചിലർക്ക്, പ്രത്യേകിച്ച് അടുത്തിടെ കണ്ടെത്തിയ മൂലകങ്ങൾ, അവ പൊതുവായ പേരിൽ നിന്ന് ഉരുത്തിരിഞ്ഞതാണ്. ഉദാഹരണത്തിന്, ഹീലിയത്തെ പ്രതിനിധീകരിക്കുന്നത് He എന്ന ചിഹ്നമാണ്, ഇത് മിക്ക ഭാഷകളിലും പൊതുവായ പേരിനോട് അടുത്താണ്. അതേ സമയം, ഇരുമ്പ് അതിൻ്റെ ലാറ്റിൻ നാമത്തിൻ്റെ ചുരുക്കെഴുത്താണ് Fe ആയി നിയുക്തമാക്കിയിരിക്കുന്നത്.
-
മൂലകത്തിൻ്റെ മുഴുവൻ പേര് പട്ടികയിൽ നൽകിയിട്ടുണ്ടെങ്കിൽ അത് ശ്രദ്ധിക്കുക.ഈ മൂലകം "പേര്" സാധാരണ വാചകങ്ങളിൽ ഉപയോഗിക്കുന്നു. ഉദാഹരണത്തിന്, "ഹീലിയം", "കാർബൺ" എന്നിവ മൂലകങ്ങളുടെ പേരുകളാണ്. സാധാരണയായി, എല്ലായ്പ്പോഴും അല്ലെങ്കിലും, മൂലകങ്ങളുടെ മുഴുവൻ പേരുകളും അവയുടെ രാസ ചിഹ്നത്തിന് ചുവടെ പട്ടികപ്പെടുത്തിയിരിക്കുന്നു.
- ചിലപ്പോൾ പട്ടിക മൂലകങ്ങളുടെ പേരുകൾ സൂചിപ്പിക്കുന്നില്ല, അവയുടെ രാസ ചിഹ്നങ്ങൾ മാത്രം നൽകുന്നു.
-
ആറ്റോമിക് നമ്പർ കണ്ടെത്തുക.സാധാരണഗതിയിൽ, ഒരു മൂലകത്തിൻ്റെ ആറ്റോമിക നമ്പർ ബന്ധപ്പെട്ട സെല്ലിൻ്റെ മുകൾഭാഗത്തോ മധ്യത്തിലോ മൂലയിലോ സ്ഥിതിചെയ്യുന്നു. ഇത് മൂലകത്തിൻ്റെ ചിഹ്നത്തിനോ പേരിനോ കീഴിലും ദൃശ്യമാകാം. മൂലകങ്ങൾക്ക് 1 മുതൽ 118 വരെ ആറ്റോമിക സംഖ്യകളുണ്ട്.
- ആറ്റോമിക നമ്പർ എപ്പോഴും ഒരു പൂർണ്ണസംഖ്യയാണ്.
-
ആറ്റോമിക് നമ്പർ ഒരു ആറ്റത്തിലെ പ്രോട്ടോണുകളുടെ എണ്ണവുമായി പൊരുത്തപ്പെടുന്നുവെന്ന് ഓർമ്മിക്കുക.ഒരു മൂലകത്തിൻ്റെ എല്ലാ ആറ്റങ്ങളിലും ഒരേ എണ്ണം പ്രോട്ടോണുകൾ അടങ്ങിയിരിക്കുന്നു. ഇലക്ട്രോണുകളിൽ നിന്ന് വ്യത്യസ്തമായി, ഒരു മൂലകത്തിൻ്റെ ആറ്റങ്ങളിലെ പ്രോട്ടോണുകളുടെ എണ്ണം സ്ഥിരമായി തുടരുന്നു. അല്ലെങ്കിൽ, നിങ്ങൾക്ക് മറ്റൊരു രാസ മൂലകം ലഭിക്കും!
- ഒരു മൂലകത്തിൻ്റെ ആറ്റോമിക് നമ്പറിന് ഒരു ആറ്റത്തിലെ ഇലക്ട്രോണുകളുടെയും ന്യൂട്രോണുകളുടെയും എണ്ണം നിർണ്ണയിക്കാനും കഴിയും.
-
സാധാരണയായി ഇലക്ട്രോണുകളുടെ എണ്ണം പ്രോട്ടോണുകളുടെ എണ്ണത്തിന് തുല്യമാണ്.ആറ്റം അയോണീകരിക്കപ്പെടുമ്പോൾ ഒഴിവാക്കലാണ്. പ്രോട്ടോണുകൾക്ക് പോസിറ്റീവ് ചാർജും ഇലക്ട്രോണുകൾക്ക് നെഗറ്റീവ് ചാർജും ഉണ്ട്. ആറ്റങ്ങൾ സാധാരണയായി നിഷ്പക്ഷമായതിനാൽ, അവയിൽ ഒരേ എണ്ണം ഇലക്ട്രോണുകളും പ്രോട്ടോണുകളും അടങ്ങിയിരിക്കുന്നു. എന്നിരുന്നാലും, ഒരു ആറ്റത്തിന് ഇലക്ട്രോണുകൾ നേടാനോ നഷ്ടപ്പെടാനോ കഴിയും, ഈ സാഹചര്യത്തിൽ അത് അയോണീകരിക്കപ്പെടുന്നു.
- അയോണുകൾക്ക് വൈദ്യുത ചാർജ് ഉണ്ട്. ഒരു അയോണിന് കൂടുതൽ പ്രോട്ടോണുകൾ ഉണ്ടെങ്കിൽ, അതിന് പോസിറ്റീവ് ചാർജ് ഉണ്ട്, ഈ സാഹചര്യത്തിൽ മൂലക ചിഹ്നത്തിന് ശേഷം ഒരു പ്ലസ് ചിഹ്നം സ്ഥാപിക്കുന്നു. ഒരു അയോണിൽ കൂടുതൽ ഇലക്ട്രോണുകൾ അടങ്ങിയിട്ടുണ്ടെങ്കിൽ, അതിന് ഒരു നെഗറ്റീവ് ചാർജ് ഉണ്ട്, ഇത് ഒരു മൈനസ് ചിഹ്നത്താൽ സൂചിപ്പിക്കുന്നു.
- ആറ്റം ഒരു അയോണല്ലെങ്കിൽ പ്ലസ്, മൈനസ് ചിഹ്നങ്ങൾ ഉപയോഗിക്കില്ല.
-
ആവർത്തനപ്പട്ടിക, അല്ലെങ്കിൽ രാസ മൂലകങ്ങളുടെ ആവർത്തനപ്പട്ടിക, മുകളിൽ ഇടത് മൂലയിൽ ആരംഭിച്ച് പട്ടികയുടെ അവസാന വരിയുടെ (താഴെ വലത് മൂല) അവസാനം അവസാനിക്കുന്നു. പട്ടികയിലെ മൂലകങ്ങൾ അവയുടെ ആറ്റോമിക സംഖ്യയുടെ ക്രമത്തിൽ ഇടത്തുനിന്ന് വലത്തോട്ട് ക്രമീകരിച്ചിരിക്കുന്നു. ഒരു ആറ്റത്തിൽ എത്ര പ്രോട്ടോണുകൾ അടങ്ങിയിട്ടുണ്ടെന്ന് ആറ്റോമിക് നമ്പർ കാണിക്കുന്നു. കൂടാതെ, ആറ്റോമിക നമ്പർ വർദ്ധിക്കുന്നതിനനുസരിച്ച്, ആറ്റോമിക പിണ്ഡവും വർദ്ധിക്കുന്നു. അങ്ങനെ, ആവർത്തനപ്പട്ടികയിലെ ഒരു മൂലകത്തിൻ്റെ സ്ഥാനം അനുസരിച്ച്, അതിൻ്റെ ആറ്റോമിക പിണ്ഡം നിർണ്ണയിക്കാനാകും.
ഒരു കാലഘട്ടം എന്നത് രാസ മൂലകങ്ങളുടെ ആനുകാലിക വ്യവസ്ഥയുടെ ഒരു നിരയാണ്, ന്യൂക്ലിയർ ചാർജ് വർദ്ധിപ്പിക്കുന്നതിനും പുറം ഇലക്ട്രോൺ ഷെല്ലിൽ ഇലക്ട്രോണുകൾ നിറയ്ക്കുന്നതിനുമുള്ള ആറ്റങ്ങളുടെ ഒരു ശ്രേണി.
ആവർത്തനപ്പട്ടികയിൽ ഏഴ് കാലഘട്ടങ്ങളുണ്ട്. 2 മൂലകങ്ങൾ അടങ്ങുന്ന ആദ്യ കാലഘട്ടം, അതുപോലെ തന്നെ 8 മൂലകങ്ങൾ വീതമുള്ള രണ്ടാമത്തെയും മൂന്നാമത്തേയും ചെറുത് എന്ന് വിളിക്കുന്നു. 18 അല്ലെങ്കിൽ അതിലധികമോ മൂലകങ്ങളുള്ള ശേഷിക്കുന്ന കാലഘട്ടങ്ങൾ വലുതാണ്. ഏഴാമത്തെ പിരീഡ് പൂർത്തിയായിട്ടില്ല. ഒരു രാസ മൂലകം ഉൾപ്പെടുന്ന കാലഘട്ടത്തിൻ്റെ എണ്ണം നിർണ്ണയിക്കുന്നത് അതിൻ്റെ ഇലക്ട്രോൺ ഷെല്ലുകളുടെ (ഊർജ്ജ നിലകൾ) അടിസ്ഥാനത്തിലാണ്.
ആറ്റോമിക് ന്യൂക്ലിയസിൻ്റെ ചാർജ് നമ്പർ (പര്യായങ്ങൾ: ആറ്റോമിക് നമ്പർ, ആറ്റോമിക് നമ്പർ, ഒരു രാസ മൂലകത്തിൻ്റെ ഓർഡിനൽ നമ്പർ) ആറ്റോമിക് ന്യൂക്ലിയസിലെ പ്രോട്ടോണുകളുടെ എണ്ണമാണ്. ചാർജ് നമ്പർ പ്രാഥമിക ചാർജിൻ്റെ യൂണിറ്റുകളിലെ ന്യൂക്ലിയസിൻ്റെ ചാർജിന് തുല്യമാണ്, അതേ സമയം ആവർത്തനപ്പട്ടികയിലെ ന്യൂക്ലിയസുമായി ബന്ധപ്പെട്ട രാസ മൂലകത്തിൻ്റെ സീരിയൽ നമ്പറിന് തുല്യമാണ്.
ഒരേ ഇലക്ട്രോണിക് ഘടനയുള്ള ന്യൂക്ലിയർ ചാർജ് വർദ്ധിപ്പിക്കുന്ന ആറ്റങ്ങളുടെ ഒരു ശ്രേണിയാണ് രാസ മൂലകങ്ങളുടെ ആവർത്തന വ്യവസ്ഥയുടെ ഒരു കൂട്ടം.
പീരിയോഡിക് സിസ്റ്റത്തിൻ്റെ ഹ്രസ്വകാല പതിപ്പിൽ, ഗ്രൂപ്പുകളെ ഉപഗ്രൂപ്പുകളായി തിരിച്ചിരിക്കുന്നു - പ്രധാന (അല്ലെങ്കിൽ ഉപഗ്രൂപ്പുകൾ എ), ഒന്നും രണ്ടും കാലഘട്ടങ്ങളിലെ ഘടകങ്ങളിൽ നിന്ന് ആരംഭിക്കുന്നു, കൂടാതെ ഡി-ഘടകങ്ങൾ അടങ്ങിയ ദ്വിതീയ (ഉപഗ്രൂപ്പുകൾ ബി). ഏറ്റവും കുറഞ്ഞ ന്യൂക്ലിയർ ചാർജ് ഉള്ള മൂലകത്തിൻ്റെ പേരിലാണ് ഉപഗ്രൂപ്പുകൾക്ക് പേരു നൽകിയിരിക്കുന്നത് (സാധാരണയായി പ്രധാന ഉപഗ്രൂപ്പുകളുടെ രണ്ടാം കാലഘട്ടത്തിലെ മൂലകവും ദ്വിതീയ ഉപഗ്രൂപ്പുകൾക്ക് നാലാം കാലഘട്ടത്തിലെ ഘടകവും). ഒരേ ഉപഗ്രൂപ്പിലെ മൂലകങ്ങൾക്ക് സമാനമായ രാസ ഗുണങ്ങളുണ്ട്.
രസതന്ത്രത്തിലെ ഒരു കാലഘട്ടം എന്താണ്
- പിരീഡ് എന്നത് രാസ മൂലകങ്ങളുടെ ആനുകാലിക വ്യവസ്ഥയുടെ ഒരു നിരയാണ്, ന്യൂക്ലിയർ ചാർജ് വർദ്ധിപ്പിക്കുന്നതിനും ഇലക്ട്രോണുകൾ ഉപയോഗിച്ച് ബാഹ്യ ഇലക്ട്രോൺ ഷെല്ലിൽ നിറയ്ക്കുന്നതിനുമുള്ള ആറ്റങ്ങളുടെ ഒരു ശ്രേണി.
ആവർത്തനപ്പട്ടികയിൽ ഏഴ് കാലഘട്ടങ്ങളുണ്ട്. 2 മൂലകങ്ങൾ അടങ്ങുന്ന ആദ്യ കാലഘട്ടം, അതുപോലെ തന്നെ 8 മൂലകങ്ങൾ വീതമുള്ള രണ്ടാമത്തെയും മൂന്നാമത്തേയും ചെറുത് എന്ന് വിളിക്കുന്നു. 18 അല്ലെങ്കിൽ അതിലധികമോ മൂലകങ്ങളുള്ള ശേഷിക്കുന്ന കാലഘട്ടങ്ങൾ വലുതാണ്. ഏഴാമത്തെ പിരീഡ് പൂർത്തിയായിട്ടില്ല. ഒരു രാസ മൂലകം ഉൾപ്പെടുന്ന കാലഘട്ടത്തിൻ്റെ എണ്ണം നിർണ്ണയിക്കുന്നത് അതിൻ്റെ ഇലക്ട്രോൺ ഷെല്ലുകളുടെ (ഊർജ്ജ നിലകൾ) അടിസ്ഥാനത്തിലാണ്.
ഓരോ കാലഘട്ടവും (ആദ്യത്തേത് ഒഴികെ) ഒരു സാധാരണ ലോഹത്തിൽ (Li, Na, K, Rb, Cs, Fr) ആരംഭിച്ച് ഒരു നോബിൾ വാതകത്തിൽ (He, Ne, Ar, Kr, Xe, Rn) അവസാനിക്കുന്നു. ഒരു സാധാരണ നോൺ-മെറ്റൽ.
ഡോൺ#769;തീയതി#769; ആറ്റോമിക് ന്യൂക്ലിയസ് (പര്യായങ്ങൾ: ആറ്റോമിക് നമ്പർ, ആറ്റോമിക് നമ്പർ, ഒരു രാസ മൂലകത്തിൻ്റെ ആറ്റോമിക് നമ്പർ) ഒരു ആറ്റോമിക് ന്യൂക്ലിയസിലെ പ്രോട്ടോണുകളുടെ എണ്ണം. ചാർജ് നമ്പർ പ്രാഥമിക ചാർജിൻ്റെ യൂണിറ്റുകളിലെ ന്യൂക്ലിയസിൻ്റെ ചാർജിന് തുല്യമാണ്, അതേ സമയം ആവർത്തനപ്പട്ടികയിലെ ന്യൂക്ലിയസുമായി ബന്ധപ്പെട്ട രാസ മൂലകത്തിൻ്റെ സീരിയൽ നമ്പറിന് തുല്യമാണ്.
ഒരേ ഇലക്ട്രോണിക് ഘടനയുള്ള ന്യൂക്ലിയർ ചാർജ് വർദ്ധിപ്പിക്കുന്ന ആറ്റങ്ങളുടെ ഒരു ശ്രേണിയാണ് രാസ മൂലകങ്ങളുടെ ആവർത്തന വ്യവസ്ഥയുടെ ഒരു കൂട്ടം.
ആറ്റത്തിൻ്റെ പുറം ഷെല്ലിലെ ഇലക്ട്രോണുകളുടെ എണ്ണം (വാലൻസ് ഇലക്ട്രോണുകൾ) അനുസരിച്ചാണ് ഗ്രൂപ്പ് നമ്പർ നിർണ്ണയിക്കുന്നത്, ചട്ടം പോലെ, ആറ്റത്തിൻ്റെ ഉയർന്ന വാലൻസിയുമായി യോജിക്കുന്നു.
പീരിയോഡിക് സിസ്റ്റത്തിൻ്റെ ഹ്രസ്വകാല പതിപ്പിൽ, ഗ്രൂപ്പുകളെ പ്രധാന ഉപഗ്രൂപ്പുകളായി (അല്ലെങ്കിൽ ഉപഗ്രൂപ്പുകൾ എ) വിഭജിച്ചിരിക്കുന്നു, ഒന്നാമത്തെയും രണ്ടാമത്തെയും കാലഘട്ടങ്ങളിലെ ഘടകങ്ങളിൽ നിന്ന് ആരംഭിക്കുന്നു, കൂടാതെ ഡി-എലമെൻ്റുകൾ അടങ്ങിയ ദ്വിതീയ (ഉപഗ്രൂപ്പുകൾ ബി). ഏറ്റവും കുറഞ്ഞ ന്യൂക്ലിയർ ചാർജ് ഉള്ള മൂലകത്തിൻ്റെ പേരിലാണ് ഉപഗ്രൂപ്പുകൾക്ക് പേര് നൽകിയിരിക്കുന്നത് (സാധാരണയായി പ്രധാന ഉപഗ്രൂപ്പുകളുടെ രണ്ടാം കാലഘട്ടത്തിലെ മൂലകവും അനുബന്ധ ഉപഗ്രൂപ്പുകളുടെ നാലാമത്തെ കാലയളവിലെ ഘടകവുമാണ്). ഒരേ ഉപഗ്രൂപ്പിലെ മൂലകങ്ങൾക്ക് സമാനമായ രാസ ഗുണങ്ങളുണ്ട്.
ഒരേ ഗ്രൂപ്പിലെ മൂലകങ്ങളുടെ ന്യൂക്ലിയർ ചാർജിൻ്റെ വർദ്ധനവോടെ, ഇലക്ട്രോൺ ഷെല്ലുകളുടെ എണ്ണത്തിലെ വർദ്ധനവ് കാരണം, ആറ്റോമിക് ആരങ്ങൾ വർദ്ധിക്കുന്നു, അതിൻ്റെ ഫലമായി ഇലക്ട്രോനെഗറ്റിവിറ്റി കുറയുന്നു, ലോഹത്തിൻ്റെ വർദ്ധനവ്, ലോഹേതര ഗുണങ്ങളുടെ ദുർബലത എന്നിവ മൂലകങ്ങളുടെ, അവ രൂപപ്പെടുന്ന പദാർത്ഥങ്ങളുടെ ഓക്സിഡേറ്റീവ് ഗുണങ്ങൾ കുറയ്ക്കുന്നതിലും ദുർബലപ്പെടുത്തുന്നതിലും വർദ്ധനവ്.
- പട്ടികയിലെ തിരശ്ചീന വരികൾ. മെൻഡലീവ്
- തിരശ്ചീന രേഖ (ta sho zleva) പട്ടിക. മെൻഡലേവ്
രാസ മൂലകങ്ങളുടെ ആവർത്തനപ്പട്ടികയുടെ പരിണാമം
വ്യവസ്ഥിതിയിൽ ഒരു മൂലകത്തിൻ്റെ സ്ഥാനത്തെക്കുറിച്ച് മെൻഡലീവ് അവതരിപ്പിച്ച ആശയം രാസ മൂലകങ്ങളുടെ ആനുകാലിക വ്യവസ്ഥയുടെ പരിണാമത്തിന് സവിശേഷവും പ്രധാനപ്പെട്ടതുമായി മാറി; മൂലകത്തിൻ്റെ സ്ഥാനം നിർണ്ണയിക്കുന്നത് കാലയളവും ഗ്രൂപ്പ് നമ്പറുകളുമാണ്. ഈ ആശയത്തെ അടിസ്ഥാനമാക്കി, മെൻഡലീവ് ചില മൂലകങ്ങളുടെ (U, In, Ce, അതിൻ്റെ അനലോഗ്) അന്നത്തെ അംഗീകൃത ആറ്റോമിക് ഭാരം മാറ്റേണ്ടത് ആവശ്യമാണെന്ന നിഗമനത്തിലെത്തി, ഇത് ആറ്റോമിക് ഭാരത്തിൻ്റെ ആദ്യത്തെ പ്രായോഗിക പ്രയോഗമായിരുന്നു. e., കൂടാതെ P. യുടെ ശൂന്യമായ സെല്ലുകളുമായി പൊരുത്തപ്പെടുന്ന നിരവധി അജ്ഞാത മൂലകങ്ങളുടെ നിലനിൽപ്പും അടിസ്ഥാന ഗുണങ്ങളും ആദ്യമായി പ്രവചിച്ചു. ഇ. "ekaaluminum" (ഭാവിയിലെ Ga, 1875-ൽ P. Lecoq de Boisbaudran കണ്ടുപിടിച്ചത്), "ecaboron" (Sc, സ്വീഡിഷ് ശാസ്ത്രജ്ഞൻ L. Nilsson 1879-ൽ കണ്ടുപിടിച്ചത്), "ekasilicon" (Ge, കണ്ടുപിടിച്ചത്) എന്നിവയുടെ പ്രവചനം ഒരു മികച്ച ഉദാഹരണമാണ്. 1886-ൽ ജർമ്മൻ ശാസ്ത്രജ്ഞനായ കെ. വിങ്ക്ലർ). കൂടാതെ, മാംഗനീസ് (ഭാവിയിൽ Tc, Re), ടെല്ലൂറിയം (Po), അയോഡിൻ (At), സീസിയം (Fr), ബേരിയം (Ra), ടാൻ്റലം (Pa) എന്നിവയുടെ അനലോഗ് അസ്തിത്വം മെൻഡലീവ് പ്രവചിച്ചു.
ആനുകാലിക നിയമത്തിൻ്റെ ഭൗതിക അർത്ഥം വ്യക്തമല്ലാത്തതിനാലും ആറ്റോമിക് ഭാരത്തിൻ്റെ വർദ്ധനവിനെ ആശ്രയിച്ച് മൂലകങ്ങളുടെ ഗുണങ്ങളിൽ കാലാനുസൃതമായ മാറ്റത്തിനുള്ള കാരണങ്ങളെക്കുറിച്ച് വിശദീകരണമൊന്നും ഇല്ലാത്തതിനാലും പല തരത്തിൽ, ഇത് വസ്തുതകളുടെ അനുഭവപരമായ സാമാന്യവൽക്കരണത്തെ പ്രതിനിധീകരിക്കുന്നു.
ഇത് ആനുകാലിക നിയമത്തിൻ്റെ ഭൗതികമായ സ്ഥിരീകരണത്തിലേക്കും P. യുടെ സിദ്ധാന്തത്തിൻ്റെ വികാസത്തിലേക്കും പോകുന്നു. ഇ. പല വസ്തുതകളും വിശദീകരിക്കാൻ കഴിഞ്ഞില്ല. അങ്ങനെ, 19-ആം നൂറ്റാണ്ടിൻ്റെ അവസാനത്തെ കണ്ടെത്തൽ അപ്രതീക്ഷിതമായിരുന്നു. P. s-ൽ സ്ഥാനമില്ലെന്ന് തോന്നിയ നിഷ്ക്രിയ വാതകങ്ങൾ. ഇ.; പി ഉൾപ്പെടുത്തിയതിന് നന്ദി ഈ ബുദ്ധിമുട്ട് ഇല്ലാതാക്കി. ഇ. സ്വതന്ത്ര പൂജ്യം ഗ്രൂപ്പ് (പിന്നീട് VIIIa-ഉപഗ്രൂപ്പ്). ഇരുപതാം നൂറ്റാണ്ടിൻ്റെ തുടക്കത്തിൽ നിരവധി "റേഡിയോ മൂലകങ്ങളുടെ" കണ്ടെത്തൽ. P. കളിലെ അവരുടെ പ്ലേസ്മെൻ്റിൻ്റെ ആവശ്യകത തമ്മിലുള്ള വൈരുദ്ധ്യത്തിലേക്ക് നയിച്ചു. ഇ. അതിൻ്റെ ഘടനയും (അത്തരത്തിലുള്ള 30-ലധികം ഘടകങ്ങൾക്ക് ആറാമത്തെയും ഏഴാമത്തെയും കാലഘട്ടങ്ങളിൽ 7 "ഒഴിഞ്ഞ" സ്ഥലങ്ങൾ ഉണ്ടായിരുന്നു). ഐസോടോപ്പുകളുടെ കണ്ടെത്തലിൻ്റെ ഫലമായി ഈ വൈരുദ്ധ്യം മറികടക്കാൻ കഴിഞ്ഞു. അവസാനമായി, മൂലകങ്ങളുടെ ഗുണവിശേഷതകൾ നിർണ്ണയിക്കുന്ന ഒരു പരാമീറ്ററെന്ന നിലയിൽ ആറ്റോമിക് ഭാരം (ആറ്റോമിക് പിണ്ഡം) മൂല്യം ക്രമേണ അതിൻ്റെ പ്രാധാന്യം നഷ്ടപ്പെട്ടു.
രാസ മൂലകങ്ങളുടെ ആവർത്തന പട്ടികയുടെ ഘടന.
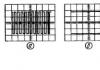
മോഡേൺ (1975) പി. പി. ഇ. 106 രാസ ഘടകങ്ങൾ ഉൾക്കൊള്ളുന്നു; ഇവയിൽ, എല്ലാ ട്രാൻസ്യുറേനിയവും (Z = 93-106), കൂടാതെ Z = 43 (Tc), 61 (Pm), 85 (At), 87 (Fr) ഉള്ള മൂലകങ്ങളും കൃത്രിമമായി ലഭിച്ചു. പിയുടെ ചരിത്രത്തിലുടനീളം. ഇ. അതിൻ്റെ ഗ്രാഫിക് പ്രാതിനിധ്യത്തിനായി ഒരു വലിയ സംഖ്യ (നൂറോളം) ഓപ്ഷനുകൾ നിർദ്ദേശിക്കപ്പെട്ടു, പ്രധാനമായും പട്ടികകളുടെ രൂപത്തിൽ; വിവിധ ജ്യാമിതീയ രൂപങ്ങൾ (സ്പേഷ്യൽ, പ്ലാനർ), അനലിറ്റിക്കൽ കർവുകൾ (ഉദാഹരണത്തിന്, സർപ്പിളുകൾ) മുതലായവയുടെ രൂപത്തിലും ചിത്രങ്ങൾ അറിയപ്പെടുന്നു. പി.യുടെ മൂന്ന് രൂപങ്ങൾ ഏറ്റവും വ്യാപകമാണ്.
e.: ഹ്രസ്വമായത്, മെൻഡലീവ് നിർദ്ദേശിച്ചതും (ചിത്രം 2) സാർവത്രിക അംഗീകാരം ലഭിച്ചതും (അതിൻ്റെ ആധുനിക രൂപത്തിൽ ഇത് ചിത്രീകരണത്തിൽ നൽകിയിരിക്കുന്നു); നീണ്ട (ചിത്രം 3); ഗോവണി (ചിത്രം 4). നീണ്ട രൂപവും മെൻഡലീവ് വികസിപ്പിച്ചെടുത്തു, മെച്ചപ്പെട്ട രൂപത്തിൽ ഇത് 1905-ൽ എ. വെർണർ നിർദ്ദേശിച്ചു. ഇംഗ്ലീഷ് ശാസ്ത്രജ്ഞനായ ടി. ബെയ്ലി (1882), ഡാനിഷ് ശാസ്ത്രജ്ഞനായ ജെ. തോംസെൻ (1895) എന്നിവർ നിർദ്ദേശിച്ച ഗോവണി രൂപം എൻ. ബോർ (1921) മെച്ചപ്പെടുത്തി. മൂന്ന് രൂപങ്ങളിൽ ഓരോന്നിനും ഗുണങ്ങളും ദോഷങ്ങളുമുണ്ട്. P. കൾ നിർമ്മിക്കുന്നതിനുള്ള അടിസ്ഥാന തത്വം. ഇ. എല്ലാ രാസ മൂലകങ്ങളെയും ഗ്രൂപ്പുകളിലേക്കും കാലഘട്ടങ്ങളിലേക്കും വിഭജിക്കുന്നതാണ്. ഓരോ ഗ്രൂപ്പിനെയും മെയിൻ (എ), ദ്വിതീയ (ബി) ഉപഗ്രൂപ്പുകളായി തിരിച്ചിരിക്കുന്നു. ഓരോ ഉപഗ്രൂപ്പിലും സമാനമായ രാസ ഗുണങ്ങളുള്ള ഘടകങ്ങൾ അടങ്ങിയിരിക്കുന്നു. ഓരോ ഗ്രൂപ്പിലെയും എ-, ബി-ഉപഗ്രൂപ്പുകളുടെ ഘടകങ്ങൾ, ഒരു ചട്ടം പോലെ, പരസ്പരം ഒരു നിശ്ചിത രാസ സാമ്യം പ്രകടിപ്പിക്കുന്നു, പ്രധാനമായും ഉയർന്ന ഓക്സിഡേഷൻ അവസ്ഥകളിൽ, ഇത് ഒരു ചട്ടം പോലെ, ഗ്രൂപ്പ് നമ്പറുമായി യോജിക്കുന്നു. ഒരു ആൽക്കലി ലോഹത്തിൽ ആരംഭിച്ച് നിഷ്ക്രിയ വാതകത്തിൽ അവസാനിക്കുന്ന മൂലകങ്ങളുടെ ശേഖരമാണ് ഒരു കാലഘട്ടം (ഒരു പ്രത്യേക കേസ് ആദ്യ കാലഘട്ടമാണ്); ഓരോ കാലഘട്ടത്തിലും കർശനമായി നിർവചിക്കപ്പെട്ട ഘടകങ്ങളുടെ എണ്ണം അടങ്ങിയിരിക്കുന്നു. പി.എസ്. ഇ. 8 ഗ്രൂപ്പുകളും 7 പിരീഡുകളും അടങ്ങുന്നു (ഏഴാമത്തേത് ഇതുവരെ പൂർത്തിയായിട്ടില്ല).
മൂലകങ്ങളുടെ ആവർത്തനപ്പട്ടികയുടെ ആദ്യ കാലഘട്ടം
ആദ്യ കാലഘട്ടത്തിൻ്റെ പ്രത്യേകത അതിൽ 2 ഘടകങ്ങൾ മാത്രമേ അടങ്ങിയിട്ടുള്ളൂ എന്നതാണ്: H, He. സിസ്റ്റത്തിൽ H ൻ്റെ സ്ഥാനം അവ്യക്തമാണ്: ആൽക്കലി ലോഹങ്ങൾക്കും ഹാലോജനുകൾക്കും പൊതുവായുള്ള ഗുണങ്ങൾ ഹൈഡ്രജൻ കാണിക്കുന്നു; ഇത് Ia- അല്ലെങ്കിൽ (വെയിലത്ത്) VIIa-ഉപഗ്രൂപ്പിൽ സ്ഥാപിച്ചിരിക്കുന്നു. VIIa ഉപഗ്രൂപ്പിൻ്റെ ആദ്യ പ്രതിനിധിയാണ് ഹീലിയം (എന്നിരുന്നാലും, വളരെക്കാലമായി അവനും എല്ലാ നിഷ്ക്രിയ വാതകങ്ങളും ഒരു സ്വതന്ത്ര പൂജ്യം ഗ്രൂപ്പായി സംയോജിപ്പിച്ചു).
മൂലകങ്ങളുടെ ആവർത്തനപ്പട്ടികയുടെ രണ്ടാം കാലഘട്ടം
രണ്ടാമത്തെ കാലഘട്ടത്തിൽ (ലി - നെ) 8 ഘടകങ്ങൾ അടങ്ങിയിരിക്കുന്നു. ഇത് ആൽക്കലി ലോഹമായ Li യിൽ നിന്നാണ് ആരംഭിക്കുന്നത്, ഇതിൻ്റെ ഒരേയൊരു ഓക്സിഡേഷൻ അവസ്ഥ I ആണ്. തുടർന്ന് Be, ഒരു ലോഹം, II ൻ്റെ ഓക്സിഡേഷൻ അവസ്ഥ വരുന്നു. അടുത്ത മൂലകം B യുടെ ലോഹ സ്വഭാവം ദുർബലമായി പ്രകടിപ്പിക്കുന്നു (ഓക്സിഡേഷൻ അവസ്ഥ III). ഇനിപ്പറയുന്ന സി ഒരു സാധാരണ നോൺ-മെറ്റൽ ആണ്, ഇത് പോസിറ്റീവായോ നെഗറ്റീവായോ ടെട്രാവാലൻ്റ് ആകാം. ഇനിപ്പറയുന്ന N, O, F, Ne എന്നിവ ലോഹങ്ങളല്ലാത്തവയാണ്, N ന് മാത്രം ഏറ്റവും ഉയർന്ന ഓക്സിഡേഷൻ അവസ്ഥ V ഗ്രൂപ്പ് നമ്പറുമായി യോജിക്കുന്നു; ഓക്സിജൻ വളരെ അപൂർവമായി മാത്രമേ പോസിറ്റീവ് വാലൻസി കാണിക്കൂ, എഫ് ഓക്സിഡേഷൻ അവസ്ഥ VI അറിയപ്പെടുന്നു. കാലയളവ് അവസാനിക്കുന്നത് നിഷ്ക്രിയ വാതകമായ Ne ലാണ്.
മൂലകങ്ങളുടെ ആവർത്തനപ്പട്ടികയുടെ മൂന്നാം കാലയളവ്
മൂന്നാമത്തെ കാലഘട്ടത്തിൽ (Na - Ar) 8 ഘടകങ്ങളും അടങ്ങിയിരിക്കുന്നു, അതിൻ്റെ ഗുണങ്ങളിലെ മാറ്റങ്ങളുടെ സ്വഭാവം രണ്ടാം കാലഘട്ടത്തിൽ നിരീക്ഷിച്ചതിന് സമാനമാണ്. എന്നിരുന്നാലും, Mg, Be-യിൽ നിന്ന് വ്യത്യസ്തമായി, B-യുമായി താരതമ്യപ്പെടുത്തുമ്പോൾ Al കൂടുതൽ ലോഹമാണ്, എന്നിരുന്നാലും Al അന്തർലീനമായി ആംഫോട്ടെറിക് ആണ്. Si, P, S, Cl, Ar എന്നിവ സാധാരണ ലോഹങ്ങളല്ല, എന്നാൽ അവയെല്ലാം (Ar ഒഴികെ) ഗ്രൂപ്പ് നമ്പറിന് തുല്യമായ ഉയർന്ന ഓക്സിഡേഷൻ അവസ്ഥകൾ പ്രകടിപ്പിക്കുന്നു. അങ്ങനെ, രണ്ട് കാലഘട്ടങ്ങളിലും, Z വർദ്ധിക്കുന്നതിനനുസരിച്ച്, ലോഹത്തിൻ്റെ ദുർബലതയും മൂലകങ്ങളുടെ നോൺ-മെറ്റാലിക് സ്വഭാവം ശക്തിപ്പെടുത്തലും നിരീക്ഷിക്കപ്പെടുന്നു. മെൻഡലീവ് രണ്ടാമത്തെയും മൂന്നാമത്തെയും കാലഘട്ടങ്ങളിലെ ഘടകങ്ങളെ (ചെറിയത്, അദ്ദേഹത്തിൻ്റെ പദാവലിയിൽ) സാധാരണ എന്ന് വിളിച്ചു. അവ പ്രകൃതിയിൽ ഏറ്റവും സാധാരണമായവയാണ് എന്നത് ശ്രദ്ധേയമാണ്, കൂടാതെ സി, എൻ, ഒ എന്നിവയും ജൈവവസ്തുക്കളുടെ (ഓർഗാനിക്) പ്രധാന ഘടകങ്ങളായ എച്ച്. ആദ്യ മൂന്ന് കാലഘട്ടങ്ങളിലെ എല്ലാ ഘടകങ്ങളും ഉപഗ്രൂപ്പുകളിൽ ഉൾപ്പെടുത്തിയിട്ടുണ്ട് a.
ആധുനിക പദാവലി - ഈ കാലഘട്ടങ്ങളിലെ ഘടകങ്ങൾ s-മൂലകങ്ങൾ (ആൽക്കലി, ആൽക്കലൈൻ എർത്ത് ലോഹങ്ങൾ), Ia-, IIa-ഉപഗ്രൂപ്പുകളുടെ ഘടകങ്ങൾ (വർണ്ണ പട്ടികയിൽ ചുവപ്പ് നിറത്തിൽ ഹൈലൈറ്റ് ചെയ്തിരിക്കുന്നു), p- ഘടകങ്ങൾ (B - Ne, At - എന്നിവയെ സൂചിപ്പിക്കുന്നു. Ar), IIIa - VIIIa ഉപഗ്രൂപ്പുകളിൽ ഉൾപ്പെടുത്തിയിട്ടുണ്ട് (അവയുടെ ചിഹ്നങ്ങൾ ഓറഞ്ചിൽ ഹൈലൈറ്റ് ചെയ്തിട്ടുണ്ട്). ചെറിയ കാലഘട്ടങ്ങളിലെ മൂലകങ്ങൾക്ക്, വർദ്ധിച്ചുവരുന്ന ആറ്റോമിക സംഖ്യകളോടെ, ആറ്റോമിക് റേഡിയയിലെ കുറവ് ആദ്യം നിരീക്ഷിക്കപ്പെടുന്നു, തുടർന്ന്, ആറ്റത്തിൻ്റെ പുറം ഷെല്ലിലെ ഇലക്ട്രോണുകളുടെ എണ്ണം ഇതിനകം ഗണ്യമായി വർദ്ധിക്കുമ്പോൾ, അവയുടെ പരസ്പര വികർഷണം ആറ്റോമിക് ആരങ്ങളുടെ വർദ്ധനവിന് കാരണമാകുന്നു. ആൽക്കലൈൻ മൂലകത്തിൽ അടുത്ത കാലഘട്ടത്തിൻ്റെ തുടക്കത്തിൽ അടുത്ത പരമാവധി എത്തുന്നു. ഏകദേശം ഇതേ പാറ്റേൺ അയോണിക് ആരങ്ങളുടെ സ്വഭാവമാണ്.
മൂലകങ്ങളുടെ ആവർത്തനപ്പട്ടികയുടെ നാലാമത്തെ കാലഘട്ടം
നാലാമത്തെ കാലഘട്ടത്തിൽ (K - Kr) 18 ഘടകങ്ങൾ അടങ്ങിയിരിക്കുന്നു (മെൻഡലീവിൻ്റെ അഭിപ്രായത്തിൽ ആദ്യത്തെ പ്രധാന കാലഘട്ടം). ആൽക്കലി ലോഹമായ കെ, ആൽക്കലൈൻ എർത്ത് Ca (s-മൂലകങ്ങൾ) എന്നിവയ്ക്ക് ശേഷം, ഉപഗ്രൂപ്പുകളിൽ ഉൾപ്പെടുത്തിയിരിക്കുന്ന പത്ത് സംക്രമണ ഘടകങ്ങൾ (Sc - Zn) അല്ലെങ്കിൽ d-മൂലകങ്ങൾ (ചിഹ്നങ്ങൾ നീലയിൽ കാണിച്ചിരിക്കുന്നു) എന്ന് വിളിക്കപ്പെടുന്ന ഒരു ശ്രേണി പിന്തുടരുന്നു. പി.കളുടെ അനുബന്ധ ഗ്രൂപ്പുകളുടെ b. ഇ. മിക്ക സംക്രമണ മൂലകങ്ങളും (എല്ലാം ലോഹങ്ങളാണ്) അവയുടെ ഗ്രൂപ്പ് നമ്പറിന് തുല്യമായ ഉയർന്ന ഓക്സിഡേഷൻ അവസ്ഥകൾ പ്രകടിപ്പിക്കുന്നു. ഒരു അപവാദം Fe - Co - Ni എന്ന ട്രയാഡ് ആണ്, ഇവിടെ അവസാനത്തെ രണ്ട് മൂലകങ്ങൾ പരമാവധി പോസിറ്റീവ് ട്രൈവാലൻ്റ് ആണ്, കൂടാതെ ചില വ്യവസ്ഥകളിൽ ഇരുമ്പ് ഓക്സിഡേഷൻ അവസ്ഥ VI ൽ അറിയപ്പെടുന്നു. Ga യിൽ ആരംഭിച്ച് Kr (p-മൂലകങ്ങൾ) എന്നതിൽ അവസാനിക്കുന്ന മൂലകങ്ങൾ a ഉപഗ്രൂപ്പുകളിൽ പെടുന്നു, കൂടാതെ അവയുടെ ഗുണങ്ങളിലെ മാറ്റത്തിൻ്റെ സ്വഭാവം രണ്ടാമത്തെയും മൂന്നാമത്തെയും കാലയളവിലെ മൂലകങ്ങളുടെ അനുബന്ധ Z ഇടവേളകളിലെ പോലെയാണ്. Kr ന് രാസ സംയുക്തങ്ങൾ (പ്രധാനമായും F) രൂപീകരിക്കാൻ കഴിയുമെന്ന് സ്ഥാപിക്കപ്പെട്ടിട്ടുണ്ട്, എന്നാൽ അതിൻ്റെ ഓക്സീകരണ നില VIII അജ്ഞാതമാണ്.
മൂലകങ്ങളുടെ ആവർത്തനപ്പട്ടികയുടെ അഞ്ചാം കാലഘട്ടം
അഞ്ചാം കാലഘട്ടം (Rb - Xe) നാലാമത്തേതിന് സമാനമായി നിർമ്മിച്ചിരിക്കുന്നു; ഇതിന് 10 സംക്രമണ ഘടകങ്ങളുടെ (Y - Cd), d-ഘടകങ്ങളുടെ ഒരു ഉൾപ്പെടുത്തലും ഉണ്ട്. കാലഘട്ടത്തിൻ്റെ പ്രത്യേക സവിശേഷതകൾ: 1) ട്രയാഡ് Ru - Rh - Pd ൽ, റുഥേനിയം മാത്രം ഓക്സീകരണ നില VIII പ്രദർശിപ്പിക്കുന്നു; 2) ഉപഗ്രൂപ്പുകളുടെ എല്ലാ ഘടകങ്ങളും, Xe ഉൾപ്പെടെ, ഗ്രൂപ്പ് നമ്പറിന് തുല്യമായ ഉയർന്ന ഓക്സിഡേഷൻ അവസ്ഥകൾ പ്രദർശിപ്പിക്കുന്നു; 3) എനിക്ക് ദുർബലമായ ലോഹ ഗുണങ്ങളുണ്ട്. അതിനാൽ, നാലാമത്തെയും അഞ്ചാമത്തെയും കാലഘട്ടങ്ങളിലെ മൂലകങ്ങൾക്ക് Z വർദ്ധിക്കുന്നതിനനുസരിച്ച് ഗുണങ്ങളിലുള്ള മാറ്റത്തിൻ്റെ സ്വഭാവം കൂടുതൽ സങ്കീർണ്ണമാണ്, കാരണം ലോഹ ഗുണങ്ങൾ ഓർഡിനൽ സംഖ്യകളുടെ വലിയ ശ്രേണിയിൽ സംരക്ഷിക്കപ്പെടുന്നു.
മൂലകങ്ങളുടെ ആവർത്തനപ്പട്ടികയുടെ ആറാമത്തെ കാലഘട്ടം
ആറാമത്തെ കാലഘട്ടത്തിൽ (Cs - Rn) 32 ഘടകങ്ങൾ ഉൾപ്പെടുന്നു. 10 d-ഘടകങ്ങൾക്ക് (La, Hf - Hg) പുറമേ, Ce മുതൽ Lu (കറുത്ത ചിഹ്നങ്ങൾ) വരെയുള്ള 14 f-ഘടകങ്ങൾ, ലാന്തനൈഡുകൾ എന്നിവ ഇതിൽ അടങ്ങിയിരിക്കുന്നു. ലാ മുതൽ ലു വരെയുള്ള മൂലകങ്ങൾ രാസപരമായി തികച്ചും സമാനമാണ്. ചുരുക്കത്തിൽ പി.എസ്. ഇ. ലാന്താനൈഡുകൾ ലാ ബോക്സിൽ ഉൾപ്പെടുത്തിയിട്ടുണ്ട് (അവയുടെ പ്രബലമായ ഓക്സിഡേഷൻ അവസ്ഥ III ആയതിനാൽ) പട്ടികയുടെ താഴെ ഒരു പ്രത്യേക വരയായി എഴുതിയിരിക്കുന്നു. 14 ഘടകങ്ങൾ പട്ടികയ്ക്ക് പുറത്തുള്ളതായി തോന്നുന്നതിനാൽ ഈ സാങ്കേതികത കുറച്ച് അസൗകര്യമാണ്. P. യുടെ നീളവും സ്റ്റെയർകേസ് രൂപങ്ങളും അത്തരമൊരു പോരായ്മയില്ല. e., P. യുടെ അവിഭാജ്യ ഘടനയുടെ പശ്ചാത്തലത്തിൽ ലന്തനൈഡുകളുടെ പ്രത്യേകത നന്നായി പ്രതിഫലിപ്പിക്കുന്നു. ഇ. കാലഘട്ടത്തിൻ്റെ സവിശേഷതകൾ: 1) ട്രയാഡ് Os - Ir - Pt ൽ, ഓസ്മിയം മാത്രം ഓക്സീകരണ നില VIII പ്രദർശിപ്പിക്കുന്നു; 2) At ന് കൂടുതൽ വ്യക്തമായ (1 നെ അപേക്ഷിച്ച്) ലോഹ സ്വഭാവമുണ്ട്; 3) Rn, പ്രത്യക്ഷത്തിൽ (അതിൻ്റെ രസതന്ത്രം കുറച്ചുകൂടി പഠിച്ചിട്ടില്ല), നിഷ്ക്രിയ വാതകങ്ങളിൽ ഏറ്റവും ക്രിയാത്മകമായിരിക്കണം.